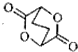
题目内容
8.NA表示阿伏加罗常数的值,下列有关叙述正确的个数为( )①1mol苯乙烯中含有的碳碳双键数为4NA
②4.2g乙烯和丙烯混合气中含有的极性键数目为0.6NA
③标况下,3.36LHF含有的电子数为1.5NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥在KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应中,每生成1mol Cl2转移的电子总数为2NA
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
分析 ①苯乙烯中含有1条碳碳双键;
②4乙烯和丙烯的最简式均为CH2,且结构中均C-H键为极性键;
③标况下,HF为液态;
④溶液越稀,NH4+的水解程度越大;
⑤NO2和N2O4的最简式均为NO2;
⑥KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应转移5mol电子生成3mol氯气;
⑦1mol铁粉在1mol氯气中充分燃烧,铁过量;
⑧求出 Fe的物质的量,然后根据铁与足量水蒸气完全反应变为+$\frac{8}{3}$来分析.
解答 解:①苯环中不含碳碳双键,故苯乙烯中含有1条碳碳双键,即1mol苯乙烯中含NA条碳碳双键,故①错误;
②乙烯和丙烯的最简式均为CH2,故4.2g混合物中含有的CH2的物质的量为0.3mol,且结构中均C-H键为极性键,故0.3molCH2中含0.6NA条极性键,故②正确;
③标况下,HF为液态,故不能根据气体摩尔体积来计算其物质的量和含有的电子数,故③错误;
④溶液越稀,NH4+的水解程度越大,故1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目前者多,故④错误;
⑤NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,则含0.3NA个原子,故⑤正确;
⑥KClO3+6HCl(浓)=KCl+3Cl2+3H2O反应转移5mol电子生成3mol氯气,故当生成1mol氯气时转移$\frac{5}{3}$NA个电子,故⑥错误;
⑦1mol铁粉在1mol氯气中充分燃烧,铁过量,而氯气反应后变为-1价,故1mol氯气得2NA个电子,则铁失去2NA个电子,故⑦错误;
⑧16.8gFe的物质的量为0.3mol,而铁与足量水蒸气完全反应变为+$\frac{8}{3}$,故0.3mol铁转移0.8NA个电子,故⑧正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

已知:①.NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe,正极反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位).(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+.过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 最简单氢化物的沸点:Y>W | |
| C. | 化合物Z2Y2与X2Y2中化学键完全相同 | |
| D. | 由Y、Z、W三种元素组成的化合物的水溶液一定显中性 |
| A. | Y的单质在氧气中燃烧生成Y2O | |
| B. | X、W的简单离子均能促进水的电离 | |
| C. | 原子半径由小到大的顺序为X<Y<Z<W | |
| D. | Z单质加入到Y的可溶性盐溶液中,可以置换出Y |
| 选项 | 实验目的 | 实验操作 |
| A | 检验蔗糖水解产物中的葡萄糖 | 取1mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热 |
| B | 除去乙烷中混有的少量乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
| C | 验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mL 1mol•L-1 NaOH溶液中加入几滴1mol•L-1 MgCl2溶液,生成白色沉淀,再加入几滴1mol•L-1 FeCl3溶液 |
| D | 硅酸胶体的制备 | 向Na2SiO3溶液(饱和溶液1:2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失 |
| A. | A | B. | B | C. | C | D. | D |
①北大研制的石墨烯弹性气凝胶(又名碳海棉)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷彩色的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 使用该分子催化剂可将一次能源太阳能直接转化成二次能源,例如电能、氢能 |
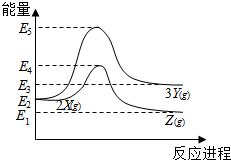
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
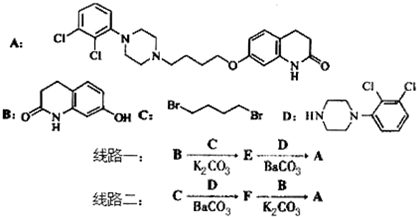
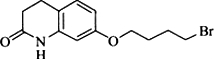 ,其含氧官能团有肽键、醚键(写名称).
,其含氧官能团有肽键、醚键(写名称).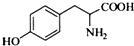 、
、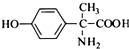 .
.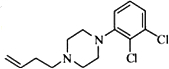 .
.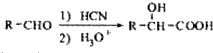 写出由C制备化合物
写出由C制备化合物