题目内容
将标准状况下aL NH3溶解于1000g水中,得到氨水的物质的量浓度为b mol/L,则该氨水的密度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:先根据n=
计算出aL氨气的物质的量,再根据氨水的物质的量浓度计算出所得溶液的体积,最后根据ρ=
计算出该氨水的密度即可.
| V |
| 22.4L/mol |
| m |
| V |
解答:
解:标准状况下aL氨气的物质的量为:n(NH3)=
=
mol,氨气的质量为:m(NH3)=17g/mol×
mol=
g,
所得溶液的质量为:1000g+
g=(1000+
)g,
所得溶液的体积为:V=
=
=
L,
该氨水的密度为:ρ=
=
=
g/L=
g/cm3,
故选B.
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| a |
| 22.4 |
| 17a |
| 22.4 |
所得溶液的质量为:1000g+
| 17a |
| 22.4 |
| 17a |
| 22.4 |
所得溶液的体积为:V=
| n |
| c |
| ||
| bmol/L |
| a |
| 22.4b |
该氨水的密度为:ρ=
| m |
| V |
(1000+
| ||
|
| (22400+17a)b |
| a |
| (22400+17a)b |
| 1700a |
故选B.
点评:本题考查了有关物质的量浓度、溶液密度相关的计算,题目难度中等,注意掌握物质的量浓度的根据及计算方法,明确溶液密度的计算方法,本题中计算溶液的体积为易错点,注意不能以水和氨气的体积作为溶液体积.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
电子表所用电源常为微型银锌原电池,其电极为A2O和Zn,电解质溶液为KOH溶液,其电极反应分别为:Zn-2e-+2OH-=Zn(OH)2,Ag2O+H2O+2e-=Ag+2OH-,下列叙述正确的是( )
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
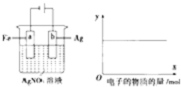 按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )
按如图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示( )①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的质量.
| A、①③ | B、③④ |
| C、①②④ | D、①②⑤ |
下列变化过程中不能直接实现的是( )
①HCl ②Cl2 ③O2 ④HClO ⑤CO2.
①HCl ②Cl2 ③O2 ④HClO ⑤CO2.
| A、①→② | B、②→④ |
| C、④→③ | D、④→⑤ |
柠檬烯是一种食用香料,其结构简式如图, 有关柠檬烯的分析不正确的是( )
有关柠檬烯的分析不正确的是( )
 有关柠檬烯的分析不正确的是( )
有关柠檬烯的分析不正确的是( )| A、柠檬烯的核磁图谱中能出现8个峰 |
| B、柠檬烯的同分异构体中属于芳香族的有12种 |
| C、柠檬烯的分子中所有的碳原子不可能在同一个平面上 |
| D、在一定条件下,柠檬烯可以发生加成、氧化、加聚等反应 |
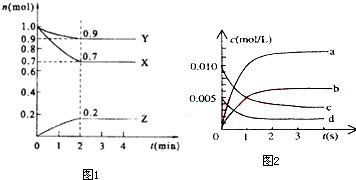
 随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.
随着人类对温室效应和资源短缺等问题的重视,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前有一种方法是用CO2来生产燃料甲醇CH3OH.在体积不变的5L密闭容器中,充入一定量的CO2和 H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);(正反应为放热反应)经过10min反应达到平衡,测得物质的浓度如下表所示.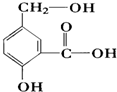 在某有机物A的分子其结构简式如图,请回答.
在某有机物A的分子其结构简式如图,请回答. 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: