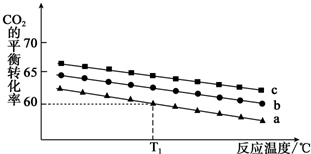
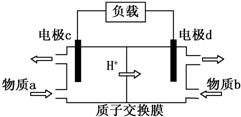
题目内容
5.在绝热情况下向四份0.1mol/L的醋酸钠溶液中分别加入少量KNO3固体、硫酸氢钾固体、氯化钠固体和硫酸铜粉末(忽略溶液体积变化),则c(Ac-)/c(Na+)的变化正确的是( )| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
分析 醋酸钠溶液中存在水解平衡:Ac-+H2O?HAc+OH-,根据条件改变对水解平衡的影响以及溶解热对体系温度的影响进行判断.
解答 解:醋酸钠溶液中存在水解平衡:Ac-+H2O?HAc+OH-,
①少量KNO3固体溶于水时吸热,导致体系温度降低,平衡逆向移动,c(Ac-)增大,而c(Na+)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$增大;
②加入少量硫酸氢钾固体,硫酸氢钾电离产生的氢离子与氢氧根离子反应,降低了c(OH-),平衡正向移动,c(Ac-)增大,而c(Na+)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$减小;
③氯化钠固体溶于水,增大了c(Na+),对平衡无影响,c(Ac-)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$减小;
④加入少量硫酸铜粉末,铜离子和氢氧根离子反应,降低了c(OH-),平衡正向移动,c(Ac-)增大,而c(Na+)不变,因此$\frac{c(A{c}^{-})}{c(N{a}^{+})}$减小;
故选C.
点评 本题考查了影响盐类水解的因素,题目难度中等,注意绝热条件下KNO3固体溶于水吸热导致体系温度降低,水解平衡逆向移动.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列反应中,硝酸既表现酸性,又表现氧化性的是( )
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
8.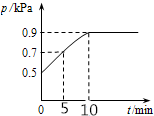 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
13.下列物质的类别与所含能团都正确的是( )
①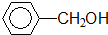 酚类-OH
酚类-OH
②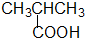 羧酸类-COOH
羧酸类-COOH
③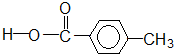 醛类
醛类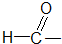
④CH3-O-CH3 醚类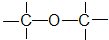
⑤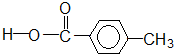 酯类
酯类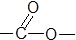
①
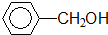 酚类-OH
酚类-OH②
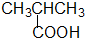 羧酸类-COOH
羧酸类-COOH③
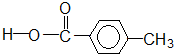 醛类
醛类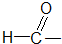
④CH3-O-CH3 醚类
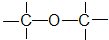
⑤
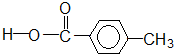 酯类
酯类
| A. | ①②③④⑤ | B. | ②④ | C. | ②③④ | D. | ②④⑤ |
17.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 23 g钠在氧气中完全燃烧失电子数为0.5NA | |
| B. | 标准状况下,22.4 L苯所含的分子数 | |
| C. | 室温下,8 g甲烷含有共价键数为2NA | |
| D. | 1 L 1 mol•L-1硫酸溶液所含的H+数 |
14.铁与铁合金是生活中常见的材料,下列说法正确的是( )
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 纯铁的硬度和强度均高于铁合金 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 一定条件下,铁粉可与水蒸气反应 |
15.下列说法正确是( )
| A. | 含有极性键的分子一定是极性分子 | B. | 单质分子一定是非极性分子 | ||
| C. | 氢键一定与氢元素有关 | D. | 共价键只存在于非金属元素之间 |