题目内容
10.(1)25℃时,0.1mol/L的HA溶液中c(H+)=10-2mol/L.请回答下列问题:①HA是弱酸(填“强酸”或“弱酸”).
②NaA溶液显碱性(填“酸性”、“中性”或“碱性”),理由是(用离子方程式表示)A-+H2O?HA+OH-.
(2)常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是AB.(填选项)
A.pH=4的醋酸 B.pH=10的NaOH溶液 C.pH=9的Na2CO3溶液 D.pH=4的NH4Cl溶液
(3)在100℃时,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH=11.(混合时溶液体积变化忽略不计)
(4)常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应.若混合后溶液呈中性,则a<b(填“<”、“=”或“>”).
(5)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,则反应后溶液中离子浓度从大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(6)氯化铝水溶液呈酸性,原因是(用离子方程式表示):Al3++3H2O?Al(OH)3+3H+.把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3.(填化学式)
(7)在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
分析 (1)①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸c(H+)=0.1mol•L-1,若是弱酸,弱酸溶液中存在电离平衡,溶液中c(H+)<0.1mol•L-1;
②NaA溶液是强碱弱酸盐,溶液中A-离子水解显碱性;
(2)常温下,水的离子积为1×10-14,c(H+)=10-7mol/L,由水电离产生的c(H+)等于10-10mol/L,纯水的离子积为1×10-20,说明该溶液中的溶质抑制了水的电离,该溶液为酸或者碱溶液,据此进行判断;
(3)先判断出酸和碱混合后溶液NaOH过量,溶液显碱性,根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$求出氢氧根的浓度,然后根据水的离子积求出c(H+),即可求出溶液的pH;
(4)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析;
(5)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性;
(6)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
(7)难溶电解质的溶度积越小,加入氨水时越易生成沉淀.
解答 解:(1)①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸c(H+)=0.1mol•L-1,若是弱酸,弱酸溶液中存在电离平衡,溶液中c(H+)<0.1mol•L-1,
25℃时,0.1mol/L的HA溶液中c(H+)=10-2mol/L,氢离子未全部电离出来,说明HA为弱酸,
故答案为:弱酸;
②NaA溶液是强碱弱酸盐,溶液中A-离子水解显碱性,反应的离子方程式为:A-+H2O?HA+OH-,
故答案为:碱性,A-+H2O?HA+OH-;
(2)常温下,水的离子积为1×10-14,c(H+)=10-7mol/L,由水电离产生的c(H+)等于10-10mol/L,纯水的离子积为1×10-20,说明该溶液中的溶质抑制了水的电离,该溶液为酸或者碱溶液,
A.pH=4的醋酸溶液电离出的氢离子抑制水的电离,故A正确;
B.pH=10的NaOH溶液中电离出的氢氧根离子抑制水的电离,故B正确;
C.pH=9的Na2CO3溶液中碳酸根离子水解,溶液显碱性,促进了水的电离,故C错误;
D.pH=4的NH4Cl溶液中铵根离子水解,溶液显酸性,促进了水的电离,故D错误;
故选AB.
(3)该温度下,将100mL 0.1mol•L-1的稀H2SO4中n(H+)=CV=0.2mol/L×0.1L=0.02mol,100mL 0.4mol•L-1的NaOH溶液中n(OH-)=CV=0.4mol/L×0.1L=0.04mol,混合后,NaOH过量,溶液显碱性,溶液中c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,由于水的离子积Kw=c(H+)•c(OH-)=10-12,c(H+)=$\frac{1{0}^{-12}}{0.1}$mol/L=10-11mol/L,PH=11,
故答案为:11;
(4)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析,a<b,
故答案为:<;
(5)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(6)氯化铝水溶液呈酸性是因为铝离子水解显酸性,Al3++3H2O?Al(OH)3+3H+,把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝,
故答案为:Al3++3H2O?Al(OH)3+3H+,Al2O3;
(7)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
点评 本题考查了酸碱反应后溶液酸碱性分析判断,离子浓度大小比较,盐类水解,溶度积常数的计算分析,影响水电离的因素分析判断,掌握基础是关键,题目难度中等.

 初中学业考试导与练系列答案
初中学业考试导与练系列答案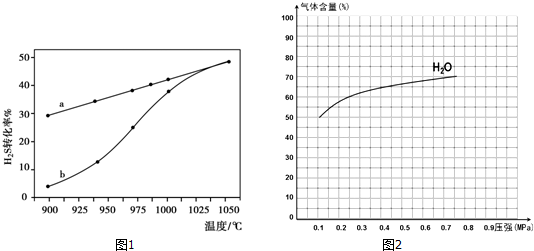
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H
在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图1所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=$\frac{0.4c}{t}$mol•L-1•min-1(用含c、t的代数式表示).
③请说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: Ⅰ:C(s)+H2O(g)═CO(g)+H2(g) K1 Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2 Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 V:CaCO3(s)═CaO(s)+CO2(g) |
②图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图2.若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol•L-1,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图.
③对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度
B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量
D.增加CaO的量,提高CO2的吸收率?
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
(1)1m3(标准状况)CH4按上式完全反应,产生H2134mol.
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应.1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为3<V<4.
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,$\frac{V(H_{2})}{V(N_{2})}$=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为(3-7a):3.
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
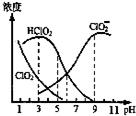
| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$═$\frac{1}{10}$ | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c( ClO2-)>c( ClO2)>c( Cl-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
| A. | 自来水中 | B. | 煤油中 | C. | 食盐水 | D. | 沙子中 |
| A. | 橡胶 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |

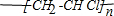
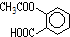 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.