题目内容
14.铁与铁合金是生活中常见的材料,下列说法正确的是( )| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 纯铁的硬度和强度均高于铁合金 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 一定条件下,铁粉可与水蒸气反应 |
分析 A.铁与盐酸反应,铁合金和盐酸也可以反应;
B.合金的强度和硬度一般比组成它们的纯金属更高,抗腐蚀性能等也更好;
C.不锈钢是铁的合金,含有非金属碳、硅等非金属,镍等金属;
D.铁粉和水蒸气在高温下反应生成四氧化三铁和氢气.
解答 解:A、铁与盐酸反应,铁合金和盐酸也可以反应,Fe+2HCl=FeCl2+H2↑,故A错误;
B、合金的强度和硬度一般比组成它们的纯金属更高,抗腐蚀性能等也更好,纯铁的硬度和强度均低于铁合金,故B错误;
C、不锈钢是铁的合金,含有非金属碳、硅等非金属,镍等金属,故C错误;
D、铁粉和水蒸气在高温下反应生成四氧化三铁和氢气,3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,故D正确;
故选D.
点评 本题考查了铁及其化合物性质的应用,合金的组成和性质判断,金属腐蚀的分析判断,题目较简单.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
5.在绝热情况下向四份0.1mol/L的醋酸钠溶液中分别加入少量KNO3固体、硫酸氢钾固体、氯化钠固体和硫酸铜粉末(忽略溶液体积变化),则c(Ac-)/c(Na+)的变化正确的是( )
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |
2.亚氯酸钠是一种高效氧化型漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是毒性很大的气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).在25℃时,下列分析正确的是( )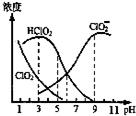

| A. | 使用该漂白剂的最佳pH为3 | |
| B. | pH=5时,溶液中$\frac{c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$═$\frac{1}{10}$ | |
| C. | pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c( ClO2-)>c( ClO2)>c( Cl-) | |
| D. | NaClO2溶液加水稀释所有离子浓度均减小 |
9.下列叙述中,正确的是( )
| A. | H2SO4的摩尔质量是98g | |
| B. | 标况下,H2的摩尔体积是22.4L | |
| C. | 将1mol NaCl溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L | |
| D. | 氧气的摩尔质量与它的相对分子质量在数值上相等 |
19.在实验室中,通常将金属钠保存在( )
| A. | 自来水中 | B. | 煤油中 | C. | 食盐水 | D. | 沙子中 |
3.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 由水电离出的c(H+)c(OH-)═10-22的溶液:Fe2+、Na+、NO3-、SO42- | |
| D. | 澄清透明的溶液中SO42-、K+、Cu2+、Cl- |
4.下列盐溶液中呈酸性的是( )
| A. | NaCl | B. | CH3COONa | C. | FeC13 | D. | NaHCO3 |