题目内容
2.根据题意回答问题:(1)中和热的测定所需的玻璃仪器有:大小烧杯、量筒、温度计、环形玻璃搅拌棒;
已知:0.55mol•L-1 HCl和0.50mol•L-1的NaOH溶液各50mL反应放出热量为1.42kJ,写出该反应的中和热的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1.
(2)101kpa时,1克乙醇(CH3CH2OH)液体完全燃烧生成稳定氧化物放出热量akJ,写出乙醇燃烧热的热化学方程式:CH3CH2OH(l)+3O2(g)=3H2O(g)+2CO2(g)△H=-46akJ•mol-1.
(3)已知H-H、O=O和O-H键的键能分别为436kJ/mol、498kJ/mol和463kJ/mol,2H2O(g)=2H2(g)+O2(g)△H2=+482kJ/mol
(4)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
已知:CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.5kJ•mol-1.
(5)①25℃时,浓度均为0.1mol/L的①氨水②氢氧化钠溶液③盐酸溶液④醋酸溶液,其c(H+)由大到小排列的顺序为:③>④>①>②(用序号填空)
②95℃时,水中的H+的物质的量浓度为10-6 mol•L-1,若把0.01mol的NaOH固体溶解于95℃水中配成1L溶液,则溶液的pH为10.
分析 (1)中和热的测定需要环形玻璃搅拌棒搅拌,充分反应而测定最高温度;0.55mol•L-1 HCl和0.50mol•L-1的NaOH溶液各50mL反应放出热量为1.42kJ,可知生成1mol时放出的热量为$\frac{1.42kJ}{0.05L×0.5mol/L}$=56.8kJ;
(2)1克乙醇(CH3CH2OH)液体完全燃烧生成稳定氧化物放出热量akJ,则1molCH3CH2OH液体完全燃烧生成稳定氧化物放出热量akJ×46=46akJ;
(3)焓变等于反应物中键能之和减去生成物中键能之和;
(4)①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
结合盖斯定律可知,①×2-②-③×2得到2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g);
(5)①等浓度时,酸性越强,氢离子浓度越大,碱性越强,氢离子浓度越小;
②95℃时,水中的H+的物质的量浓度为10-6 mol•L-1,可知Kw=10-12,0.01mol的NaOH固体溶解于95℃水中配成1L溶液,c(OH-)=0.01mol/L,则c(H+)=$\frac{1{0}^{-12}}{1{0}^{-2}}$=10-10mol•L-1,以此计算.
解答 解:(1)中和热的测定所需的玻璃仪器有:大小烧杯、量筒、温度计、环形玻璃搅拌棒,0.55mol•L-1 HCl和0.50mol•L-1的NaOH溶液各50mL反应放出热量为1.42kJ,可知生成1mol时放出的热量为$\frac{1.42kJ}{0.05L×0.5mol/L}$=56.8kJ,则中和热的热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8 kJ•mol-1,
故答案为:环形玻璃搅拌棒;HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8 kJ•mol-1;
(2)1克乙醇(CH3CH2OH)液体完全燃烧生成稳定氧化物放出热量akJ,则1molCH3CH2OH液体完全燃烧生成稳定氧化物放出热量akJ×46=46akJ,则乙醇燃烧热的热化学方程式为CH3CH2OH(l)+3O2(g)=3H2O(g)+2CO2(g)△H=-46a kJ•mol-1,
故答案为:CH3CH2OH(l)+3O2(g)=3H2O(g)+2CO2(g)△H=-46a kJ•mol-1;
(3)H-H、O=O和O-H键的键能分别为436kJ/mol、498kJ/mol和463kJ/mol,2H2O(g)=2H2(g)+O2(g)△H2=2×2×463kJ/mol-(436kJ/mol)×2-(498kJ/mol)=+482kJ/mol,
故答案为:+482kJ/mol;
(4)①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
结合盖斯定律可知,①×2-②-③×2得到2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),△H=-122.5 kJ•mol-1,即热化学方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.5 kJ•mol-1,
故答案为:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.5 kJ•mol-1;
(5)①等浓度时,酸性越强,氢离子浓度越大,碱性越强,氢离子浓度越小,则浓度均为0.1mol/L的①氨水②氢氧化钠溶液③盐酸溶液④醋酸溶液,其c(H+)由大到小排列的顺序为③>④>①>②,
故答案为:③>④>①>②;
②95℃时,水中的H+的物质的量浓度为10-6 mol•L-1,可知Kw=10-12,0.01mol的NaOH固体溶解于95℃水中配成1L溶液,c(OH-)=0.01mol/L,则c(H+)=$\frac{1{0}^{-12}}{1{0}^{-2}}$=10-10mol•L-1,pH=-lg c(H+)=10,
故答案为:10.
点评 本题考查反应热与焓变及pH的计算,为高频考点,把握中和热、燃烧热及焓变计算为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| t/min | 0 | 2 | 4 | 6 | 8 | … | 16 | 18 |
| n(X)/mol | 1.600 | 1.200 | 1.100 | 1.075 | … | … | 1.000 | 1.000 |
| A. | 4-6 min时间段内Z的平均反应速率2.5×10-3 mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=1.44 | |
| C. | 达平衡后,升高温度,K减小,则正反应△H>0 | |
| D. | 其他条件不变,再充入1.6 mol Z,达新平衡时Z的体积分数不变 |
①混合气体的压强 ②混合气体的密度 ③各气体物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量.
| A. | ②③⑤ | B. | ①②③ | C. | ②③④⑤ | D. | ①③④⑤ |
| A. | 氨气 | B. | 氮气 | C. | 氢氧化钠 | D. | 硫酸钡 |
| A. | C(s)+H2O(g)=CO(g)+H2(g)△H>0 | B. | NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0 | ||
| C. | 2CO(g)+O2(g)=2CO2(1)△H<0 | D. | 2H2(g)+O2(g)═2H2O(l)△H<0 |
| 负极 | 正极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Cu | Zn | CuCl2 |
| C | Zn | Cu | ZnCl2 |
| D | Cu | Zn | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
| 碳 | 氮 | Y | |
| X | 硫 | Z |
(1)Z元素在周期表中的位置为第三周期,第ⅤⅡA族.
(2)表中元素原子半径最大的是(写元素符号)Si.
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是ac.
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y 单质比1mol S 得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X 的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔沸点分别为-69℃和58℃,写出该反应的热化学方程式:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol.
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中的两种元素组成,气体的相对分子质量都小于50.为防止污染,将生成的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH 溶液和1mol O2,则两种气体的分子式分别为NO、NO2,物质的量分别为1.3mol、0.9mol,生成硫酸铜物质的量为2mol.
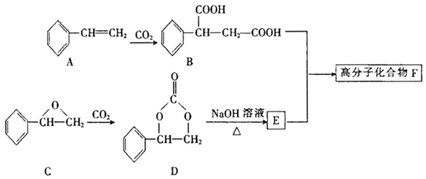
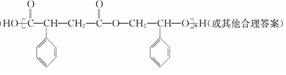
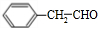 ,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为
,G与新制的Cu(OH)2悬浊液混合加热时发生反应的化学方程式为