题目内容
10.下列物质的水溶液能导电而本身是非电解质的是( )| A. | 氨气 | B. | 氮气 | C. | 氢氧化钠 | D. | 硫酸钡 |
分析 水溶液导电必须有自由移动的离子,电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物,以此分析.
解答 解:A、氨气的水溶液能导电,是因氨气和水反应生成一水合氨,一水合氨电离生成离子而导电属于电解质,发生电离不是氨气本身,故氨气属于非电解质,故A正确;
B、N2不是化合物,不溶于水,因此不属于非电解质,故B错误;
C、氢氧化钠是在水溶液中自身电离出移动的离子能导电的化合物,则属于电解质,故C错误;
D、硫酸钡水溶液中不导电,熔融状态下导电属于电解质,故D错误,
故选A.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可,题目难度不大.

练习册系列答案
相关题目
1.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 100mL 1mol/LFeCl3溶液中含有0.1NA个Fe3+ | |
| B. | 1.06g Na2CO3含有的CO32-离子数小于0.01 NA | |
| C. | PH=3的醋酸溶液中,含有的H+数为0.001NA | |
| D. | 2L 0.5mol/L的氨水中,含有NH3•H2O、NH4+、NH3的总数为1 NA |
5.下列说法中正确的是( )
| A. | 明矾的化学式为Al2(SO4)3•12H2O | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | AlCl3溶液与浓氨水反应有白色沉淀生成 | |
| D. | Al是重要的金属元素,其对应的氧化物为碱性氧化物 |
15.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol的OH-中含有的电子数为0.9NA | |
| B. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| C. | 6.02×1022个 CH4所含氢原子数为0.4NA | |
| D. | 常温常压下,28 g N2中所含原子个数为NA |
19.某溶液中只可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
下列说法正确的是( )
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
下列说法正确的是( )
| A. | 该溶液中可能含K+ | |
| B. | 该溶液中肯定含有NO3-、SO42-、NH4+、CO32- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1mol/L |
20.下列分子或离子的中心原子杂化轨道的类型相同的是( )
| A. | SO32-与SO3 | B. | CH4与H2O | C. | NCl3与BF3 | D. | SO32-与CO32- |
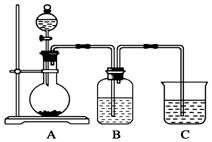 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.