题目内容
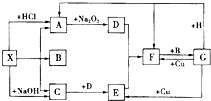 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.试解答下列各题:
(l)写出下列物质的化学式:X
(2)写出下列反应的化学方程式:H+G→A+F:
(3)写出下列反应的离子方程式:
(4)工业上合成C,合成后采用加压降温液化方法从混合气体中分离出C,能用上述方法分离出C的原因是
考点:无机物的推断
专题:推断题
分析:常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,由框图可知X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,该弱酸易分解,而且产生的气体能与Na2O2反应,猜想X应为NH4HCO3或(NH4)2CO3,又知1 mol X分解得到A、B、C各1 mol,故X只能是NH4HCO3,A为CO2,B为H2O,C为NH3,D为O2,E为NO,F为NO2,G为HNO3,H为C,据此答题.
解答:
解:常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,由框图可知X既能与酸反应生成气体A,又能与碱反应生成气体C,故X应为弱酸的铵盐,该弱酸易分解,而且产生的气体能与Na2O2反应,猜想X应为NH4HCO3或(NH4)2CO3,又知1 mol X分解得到A、B、C各1 mol,故X只能是NH4HCO3,A为CO2,B为H2O,C为NH3,D为O2,E为NO,F为NO2,G为HNO3,H为C,
(1)由以上分析可知X为NH4HCO3,B为H2O,
故答案为:NH4HCO3;H2O;
(2)H+G→A+F为C和浓硝酸的反应,方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,C+D→E的反应为4NH3+5O2
4NO+6H2O,
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;4NH3+5O2
4NO+6H2O;
(3)X为NH4HCO3,与NaOH溶液加热反应,会产生氨气和碳酸钠,反应的离子方程式为NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O;
故答案为:NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O;
(4)C为NH3,沸点较低,易液化,可用加压降温方法从混合气体中分离出,
故答案为:NH3易液化.
(1)由以上分析可知X为NH4HCO3,B为H2O,
故答案为:NH4HCO3;H2O;
(2)H+G→A+F为C和浓硝酸的反应,方程式为C+4HNO3(浓)
| ||
| ||
| △ |
故答案为:C+4HNO3(浓)
| ||
| ||
| △ |
(3)X为NH4HCO3,与NaOH溶液加热反应,会产生氨气和碳酸钠,反应的离子方程式为NH4++HCO3-+2OH-
| ||
故答案为:NH4++HCO3-+2OH-
| ||
(4)C为NH3,沸点较低,易液化,可用加压降温方法从混合气体中分离出,
故答案为:NH3易液化.
点评:本题考查无机物的推断,解题的关键的是寻找“突破口”,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等,题目中等难度,答题时注意元素化合物基础知识的灵活运用.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
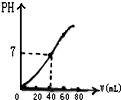 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 |
| C、用铜作阳极,电解FeCl3溶液,在阴极上可析出铜 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
下列说法中正确的是( )
| A、常温下,淀粉遇I- 变蓝色 |
| B、油脂水解可得到氨基酸和甘油 |
| C、所有烷烃和蛋白质中都只存在碳碳单键 |
| D、淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
 向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )
向100mL 0.1mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol?L-1 Ba(OH)2溶液.随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示.则下列说法中正确的是( )| A、a点对应的沉淀只有BaSO4 |
| B、c点溶液铝元素以AlO2- 的形式存在 |
| C、b点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| D、c点加入Ba(OH)2溶液的体积为200 mL |
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,分别与物质的量浓度相同,体积相同的三份AgNO3溶液恰好反应,用去的三种溶液的体积比为( )
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:1:1 |