题目内容
在Al2(SO4)3溶液中加入少量的NaOH溶液,观察到的现象是 ,将生成物分成两份,向第一份中加入过量的氢氧化钠溶液,向另一份中加入过量的稀硫酸,反应的离子方程式分别为 、 ,由此说明氢氧化铝是 (填物质类别).
考点:两性氧化物和两性氢氧化物
专题:
分析:硫酸铝与少量的NaOH反应生成Al(OH)3沉淀,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,与硫酸反应生成硫酸铝与水,说明氢氧化铝是两性氢氧化物.
解答:
解:Al2(SO4)3溶液中加入少量的NaOH溶液,发生反应:Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓,观察到的现象为:产生白色絮状沉淀,
生成的沉淀物分成两份,向第一份中加入过量的氢氧化钠溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,向另一份中加入过量的稀硫酸,氢氧化铝与硫酸反应生成硫酸铝铝与水,反应离子方程式为:Al(OH)3+3H+═Al3++3H2O,说明氢氧化铝是两性氢氧化物,
故答案为:产生白色絮状沉淀;Al(OH)3+OH-═AlO2-+2H2O;Al(OH)3+3H+═Al3++3H2O;两性氢氧化物.
生成的沉淀物分成两份,向第一份中加入过量的氢氧化钠溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,向另一份中加入过量的稀硫酸,氢氧化铝与硫酸反应生成硫酸铝铝与水,反应离子方程式为:Al(OH)3+3H+═Al3++3H2O,说明氢氧化铝是两性氢氧化物,
故答案为:产生白色絮状沉淀;Al(OH)3+OH-═AlO2-+2H2O;Al(OH)3+3H+═Al3++3H2O;两性氢氧化物.
点评:本题考查氢氧化铝的性质、离子方程式书写等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案
相关题目
三个反应常温时的平衡常数的数值如表所示,以下说法错误的是:
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92( )
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92( )
A、常温下,NO分解产生O2的反应的平衡常数表达式为K1=
| ||
| B、常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | ||
| C、常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | ||
D、反应2CO(g)+2NO(g)=N2(g)+2CO2(g)的平衡常数K4=
|
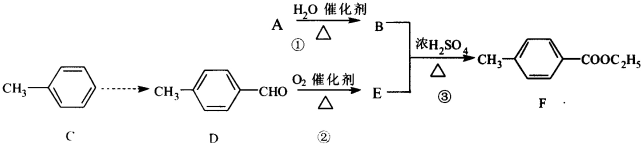
互为同分异构体的是( )
| A、A和B | B、B和E |
| C、C和H | D、C和F |
下列变化中,属于氧化还原反应又能通过一步反应实现的是( )
| A、Na→Na2O2 |
| B、Si→H2SiO3 |
| C、CuSO4→CuCl2 |
| D、Cu(OH)2→CuO |
下列化学用语中,书写正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、氮气的结构式:N≡N |
C、水分子的电子式: |
D、硫原子的结构示意图: |
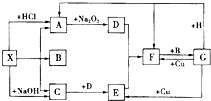 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.