题目内容
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,分别与物质的量浓度相同,体积相同的三份AgNO3溶液恰好反应,用去的三种溶液的体积比为( )
| A、1:2:3 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:1:1 |
考点:化学方程式的有关计算
专题:计算题
分析:三种溶液中的Cl-完全沉淀,所消耗的Ag+的物质的量相同,由Ag+和Cl-反应方程式可知三种溶液中Cl-的物质的量相等,三种溶液的物质的量浓度又相等,根据三种溶质的构成求出三种溶液的体积比.
解答:
解:由n=c?V可知使三种溶液中的Cl-完全沉淀时所消耗的n(Ag+)相同,根据Ag++Cl-═AgCl↓可知三种溶液中n(Cl-)=n(Ag+),即三种溶液中n(Cl-)相同,
由于三种溶液的浓度相等,设NaCl中Cl-浓度为c,则MgCl2中Cl-浓度为2c,AlCl3中Cl-浓度为3c,
则V(NaCl)×c=V(MgCl2)×2c=V(AlCl3)×3c,所以V(NaCl):V(MgCl2):V(AlCl3)=6:3:2,
故选B.
由于三种溶液的浓度相等,设NaCl中Cl-浓度为c,则MgCl2中Cl-浓度为2c,AlCl3中Cl-浓度为3c,
则V(NaCl)×c=V(MgCl2)×2c=V(AlCl3)×3c,所以V(NaCl):V(MgCl2):V(AlCl3)=6:3:2,
故选B.
点评:本题考查物质的量浓度的计算,注意从离子反应的角度去分析问题解答问题,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
下列变化中,属于氧化还原反应又能通过一步反应实现的是( )
| A、Na→Na2O2 |
| B、Si→H2SiO3 |
| C、CuSO4→CuCl2 |
| D、Cu(OH)2→CuO |
 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A、OH-+HCl=H2O+Cl- |
| B、Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓ |
| C、Fe+Cu2+=Cu+Fe2+ |
| D、Fe+2H+=Fe3++H2↑ |
下列化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、乙炔的分子式:C2H2 |
| C、顺-2-丁烯的结构简式:H3CHHCH3 |
| D、乙酸的实验式:C2H4O2 |
下列化学用语中,书写正确的是( )
| A、乙烯的结构简式:CH2CH2 |
| B、氮气的结构式:N≡N |
C、水分子的电子式: |
D、硫原子的结构示意图: |
下列说法正确的是( )
| A、气体摩尔体积的值为22.4L/mol |
| B、阿伏伽德罗常数的值为6.02×1023 |
| C、1mol硫酸的质量为98g,硫酸的摩尔质量为98g/mol |
| D、将40 g NaOH溶解于1 L水中所得溶液中溶质的物质的量浓度为1 mol?L-1 |
 在过量的盐酸中加入等质量的锌在不同的试验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的试验( )
在过量的盐酸中加入等质量的锌在不同的试验条件下进行反应,测定在不同时间t产生氢气体积v的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的试验( ) | 组别 | c(HCl)(mol?L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 粉末状 |
| 4 | 2.5 | 30 | 粉末状 |
| A、4-3-1-2 |
| B、1-2-3-4 |
| C、1-2-4-3 |
| D、3-4-2-1 |
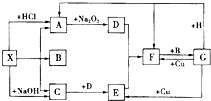 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.