题目内容
现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140mL 4.0mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0.计算:
(1)实验①中用去NaOH的物质的量为 mol;
(2)这包铝热剂中铝的质量为 克,氧化铁的质量为 克;
(3)实验②产生氢气的体积(标准状况)为 升.
①向其中一份固体中加入100mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140mL 4.0mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0.计算:
(1)实验①中用去NaOH的物质的量为
(2)这包铝热剂中铝的质量为
(3)实验②产生氢气的体积(标准状况)为
考点:有关混合物反应的计算
专题:
分析:①反应后溶液显碱性,说明溶液中元素Al都以AlO2-形式存在,Fe及其氧化物和碱不反应,则溶液里的物质就是NaAlO2、NaOH,其中OH-浓度是1mol/L,则根据钠离子守恒可知,AlO2-的物质的量就是0.1mol;
②反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;
根据反应式2Al+Fe2O3
2Fe+Al2O3可知,反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量是:0.1mol-0.06mol=0.04mol,所以Al再和盐酸的反应生成的氢气,据此解答.
②反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;
根据反应式2Al+Fe2O3
| ||
解答:
解:①反应后溶液显碱性,说明溶液中元素Al都以AlO2-形式存在,Fe及其氧化物和碱不反应,则溶液里的物质就是NaAlO2、NaOH,其中OH-浓度是1mol/L,则根据钠离子守恒可知,AlO2-的物质的量就是0.1mol;
②反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;
根据反应式2Al+Fe2O3
2Fe+Al2O3可知,反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量是:0.1mol-0.06mol=0.04mol,所以Al再和盐酸的反应生成的氢气,
(1)反应①中反应后氢氧根离子的物质的量为:1mol/L×0.1L=0.1mol,反应中消耗的氢氧化钠的物质的量为:2mol/L×0.1L-0.1mol=0.1mol;
(2)由Al元素守恒可知,每份铝热剂中n(Al)=n(AlO2-)=0.1mol,故整包铝热剂中铝的质量为:m(Al)=0.1mol×2×27g/mol=5.4g;
由Fe元素守恒可知,每份铝热剂中n(Fe2O3)=
n(Fe2+),故整包铝热剂中n(Fe2O3)=0.06mol×
×2=0.06mol,故整包铝热剂中m(Fe2O3)=0.06mol×160g/mol=9.6g,
故答案为:5.4g;9.6g;
(3)反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量为:0.1mol-0.06mol=0.04mol,Fe、Al再和盐酸的反应生成的氢气,
2Al~3H2↑,Fe~H2↑,
0.04mol 0.06mol 0.06mol 0.06mol
实验②产生气体的体积为:V=nVm=0.06mol×2×22.4L/mol=2.688L,
故答案为:2.688.
②反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;
根据反应式2Al+Fe2O3
| ||
(1)反应①中反应后氢氧根离子的物质的量为:1mol/L×0.1L=0.1mol,反应中消耗的氢氧化钠的物质的量为:2mol/L×0.1L-0.1mol=0.1mol;
(2)由Al元素守恒可知,每份铝热剂中n(Al)=n(AlO2-)=0.1mol,故整包铝热剂中铝的质量为:m(Al)=0.1mol×2×27g/mol=5.4g;
由Fe元素守恒可知,每份铝热剂中n(Fe2O3)=
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:5.4g;9.6g;
(3)反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量为:0.1mol-0.06mol=0.04mol,Fe、Al再和盐酸的反应生成的氢气,
2Al~3H2↑,Fe~H2↑,
0.04mol 0.06mol 0.06mol 0.06mol
实验②产生气体的体积为:V=nVm=0.06mol×2×22.4L/mol=2.688L,
故答案为:2.688.
点评:本题考查混合物计算、铝热反应、金属溶于酸碱的有关计算等,该题难度较大题,既要根据电荷守恒,计算离子的浓度,还要判断铝热反应中反应物的过量问题,对学生的思维能力和审题能力都提出了较高的要求.

练习册系列答案
相关题目
将足量的BaCO3分别加入:①30mL水 ②10mL0.2mol/LNa2CO3溶液 ③50m L0.01mol/LBaCl2溶液 ④100mL0.01mol/LHCl溶液中溶解至溶液饱和,请确定各溶液中Ba2+的浓度由大到小的顺序为( )
| A、①②③④ | B、③④①② |
| C、④①③② | D、②①④③ |
在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨气的速率最快的是( )
| A、v(H2)=0.3 mol?L-1?min-1 |
| B、v(N2)=0.2 mol?L-1?min-1 |
| C、v(NH3)=0.25 mol?L-1?min-1 |
| D、v(H2)=0.4 mol?L-1?min-1 |
三个反应常温时的平衡常数的数值如表所示,以下说法错误的是:
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92( )
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92( )
A、常温下,NO分解产生O2的反应的平衡常数表达式为K1=
| ||
| B、常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | ||
| C、常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | ||
D、反应2CO(g)+2NO(g)=N2(g)+2CO2(g)的平衡常数K4=
|
互为同分异构体的是( )
| A、A和B | B、B和E |
| C、C和H | D、C和F |
 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):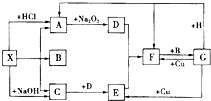 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.