题目内容
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜 |
| C、用铜作阳极,电解FeCl3溶液,在阴极上可析出铜 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.铜、铁和稀硫酸构成的原电池中,正极上氢离子放电;
B.活泼金属作阳极,阳极上金属失电子;
C.铜和氯化铁反应生成氯化亚铁;
D.构成原电池能加快较活泼金属的腐蚀速率.
B.活泼金属作阳极,阳极上金属失电子;
C.铜和氯化铁反应生成氯化亚铁;
D.构成原电池能加快较活泼金属的腐蚀速率.
解答:
解:A.铜、铁和稀硫酸构成的原电池中,铁易失电子作负极,铜作正极,正极上氢离子得电子生成氢气,所以铜电极上出现气泡,故A正确;
B.铜是活泼金属,铜作电解池阳极时,阳极上铜失电子生成铜离子,阴极上铜离子得电子生成铜,所以铁片出现一层铜,故B正确;
C.铜和氯化铁反应生成氯化亚铁和氯化铜,所以不能析出Cu,故C错误;
D.锌和铜离子反应生成铜,锌、铜和盐酸构成原电池,锌作负极,作原电池负极的金属促进被腐蚀速率,故D正确;
故选C.
B.铜是活泼金属,铜作电解池阳极时,阳极上铜失电子生成铜离子,阴极上铜离子得电子生成铜,所以铁片出现一层铜,故B正确;
C.铜和氯化铁反应生成氯化亚铁和氯化铜,所以不能析出Cu,故C错误;
D.锌和铜离子反应生成铜,锌、铜和盐酸构成原电池,锌作负极,作原电池负极的金属促进被腐蚀速率,故D正确;
故选C.
点评:本题考查了原电池原理,难度不大,易错选项是C,注意铁能置换出铜,但铜和氯化铁反应不生成铁,为易错点.

练习册系列答案
相关题目
三个反应常温时的平衡常数的数值如表所示,以下说法错误的是:
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92( )
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92( )
A、常温下,NO分解产生O2的反应的平衡常数表达式为K1=
| ||
| B、常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | ||
| C、常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | ||
D、反应2CO(g)+2NO(g)=N2(g)+2CO2(g)的平衡常数K4=
|
 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示.图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是( )| A、OH-+HCl=H2O+Cl- |
| B、Ca(OH)2+Cu2+=Ca2++Cu(OH)2↓ |
| C、Fe+Cu2+=Cu+Fe2+ |
| D、Fe+2H+=Fe3++H2↑ |
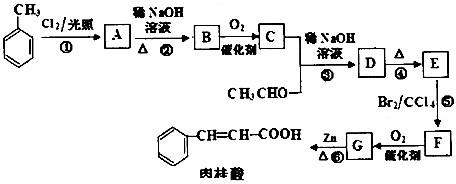
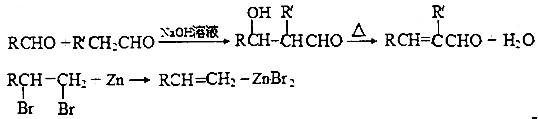
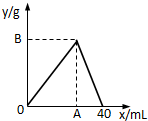 如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空:
如图是表示往50mL AlCl3溶液中滴加4mol?L-1的NaOH溶液,生成沉淀的质量(y轴)与消耗NaOH溶液的体积(x轴)的关系.填空: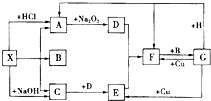 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B是液体,G是一种溶液,其余均为气体,1mol X分解得到A、B、C各1mol.