题目内容
16.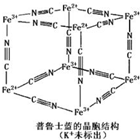 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A. | 化学式可以表示为KFe2(CN)6 | |
| B. | 每一个立方体中平均含有24个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个Fe3+周围与之相邻的Fe2+离子有12个 |
分析 A、利用均摊法计算普鲁士蓝化学式;
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键;
C、普鲁士蓝中Fe3+与CN-形成配位键;
D、Fe3+周围的Fe2+离子在顶点上.
解答 解:A、每隔一个立方体中心有一个钾离子,所以一个晶胞中钾离子个数=1÷2=0.5,该立方体中铁原子个数=$\frac{1}{8}$×8=1,CN-位于每条棱中点,该立方体中含有CN-个数=$\frac{1}{4}$×12=3,所以平均化学式是K 0.5 Fe(CN)3,化学式可以表示为KFe2(CN)6,故A正确;
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键,故B错误;
C、普鲁士蓝中Fe3+含有空轨道,CN-中N原子提供孤电子对,形成配位键,属于配合物,故C错误;
D、普鲁士蓝中Fe3+周围Fe2+离子个数为$\frac{1}{8}$×8×3=3个,故D错误.
故选:A.
点评 本题考查了晶胞的计算、配位键等知识点,难点是亚铁离子和铁离子个数比,利用平均化合价解答即可,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,1 L 1 mol•L-1的BaCl2溶液中有NA个Cl- | |
| B. | 1 mol Fe被完全氧化生成Fe3O4,失去8 NA个电子 | |
| C. | 常温常压下,14 g的CO和N2混合气体含有的原子数为NA | |
| D. | 常温常压下,22.4 L氧气与足量镁粉充分反应,转移的电子数为2NA |
4. pH=2的X、Y、Z三种酸的溶液各1mL,分别稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列正确的是 ( )
pH=2的X、Y、Z三种酸的溶液各1mL,分别稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列正确的是 ( )
 pH=2的X、Y、Z三种酸的溶液各1mL,分别稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列正确的是 ( )
pH=2的X、Y、Z三种酸的溶液各1mL,分别稀释到1000mL,其pH与溶液体积(V)的变化关系如图所示,下列正确的是 ( )| A. | X、Y和Z都是弱酸 | B. | 稀释前的浓度大小为c(Z)>c(X)>c(Y) | ||
| C. | 稀释前电离程度大小为X>Y>Z | D. | pH=2时,X、Y、Z都是稀溶液 |
1.下列物质所属类别正确的是( )
| A. | 液态氧--化合物 | B. | 纯净盐酸--纯净物 | ||
| C. | Na2O--碱性氧化物 | D. | NaHSO4--含氧酸 |
8.CuO、Fe粉、Fe3O4的混合物中,加一定量稀硫酸,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后.取出铁钉,观察现象.以下结论中正确的是( )
| A. | 若铁钉部分溶解,则滤液中一定含Fe2(SO4)3 | |
| B. | 若铁钉完全溶解,则滤液中一定含CuSO4 | |
| C. | 若铁钉表面有红色物质生成,则不溶物中一定不含Fe | |
| D. | 若铁钉无变化,则不溶物中一定含Fe |
5.下列说法正确的是( )
| A. | 常温下,铁比铝更易生锈,说明铁比铝活泼 | |
| B. | 钠比铜活泼,将钠投入硫酸铜溶液中,会有红色的铜析出 | |
| C. | 镁粉中混有的少量铝粉,可加足量NaOH溶液过滤除去 | |
| D. | 从1L 0.5mol/L FeCl3溶液中取出100mL,其中Cl-浓度为0.15 mol/L |
6.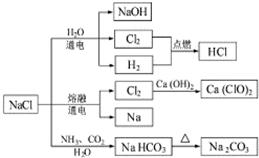 NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )
NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )
 NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )
NaCl是常用的食品调味剂,也是一种化工原料,可以制备一系列物质.下列说法正确的是( )| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的小 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下液氯能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应都是氧化还原反应 |
 按要求回答下列问题:
按要求回答下列问题: .
.