题目内容
1.下列物质所属类别正确的是( )| A. | 液态氧--化合物 | B. | 纯净盐酸--纯净物 | ||
| C. | Na2O--碱性氧化物 | D. | NaHSO4--含氧酸 |
分析 A.不同元素组成的纯净物为化合物,同种元素组成的纯净物为单质;
B.一种物质组成的为纯净物,不同物质组成的为混合物;
C.和酸反应生成盐和水的氧化物为碱性氧化物,反应为复分解反应;
D.含氧酸根离子和金属离子构成的化合物为含氧酸盐,水溶液中电离出的阳离子全部是氢离子的化合物为酸;
解答 解:A.液态氧是一种元素组成的纯净物是单质,故A错误;
B.纯净的盐酸是氯化氢气体的水溶液,属于混合物,故B错误;
C.Na2O和酸反应生成盐和水,符合碱性氧化物的概念,属于碱性氧化物,故C正确;
D.NaHSO4是钠离子和硫酸氢根离子构成的化合物是盐,不是含氧酸,故D错误;
故选C.
点评 本题考查了物质分类方法和物质组成判断,理解概念实质、掌握基础知识是解题关键,题目较简单.

练习册系列答案
相关题目
11.淀粉完全水解后的特征是( )
| A. | 能发生银镜反应 | |
| B. | 遇碘水不显兰色 | |
| C. | 与新制Cu(OH)2悬浊液反应,生成红色沉淀 | |
| D. | 有甜味 |
12.下列离子方程式的书写,正确的是( )
| A. | 金属铁与盐酸的反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氧化铜与硫酸溶液的反应:O2-+2H+═H2O | |
| C. | CuSO4溶液与Ba(OH)2溶液混合:Cu2++2OH-═Cu(OH)2↓ | |
| D. | 硫酸铝溶液与稀氨水混合:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
9.在生活、生产及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行区别、检验等.下列说法正确的是( )
| A. | 用KOH溶液可以将NH4Cl、NaBr、CuSO4、FeCl3区别开 | |
| B. | C、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| C. | 某溶液中加入稀盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,则此溶液中一定含有CO32? | |
| D. | 某溶液中先滴加氯水,再滴加KSCN溶液后显红色,则此溶液中一定含有Fe2+ |
16.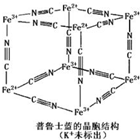 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A. | 化学式可以表示为KFe2(CN)6 | |
| B. | 每一个立方体中平均含有24个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个Fe3+周围与之相邻的Fe2+离子有12个 |
11.前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
(1)E元素基态原子核外有24种空间运动状态不同的电子,电子排布式为1s22s22p63s23p63d54s1,
F元素在元素周期表中的位置为第四周期ⅠB族,F元素基态原子的外围电子排布图是 .
.
(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为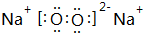 .
.
(3)A、B、C、D四种元素第一电离能由大到小的顺序为(用元素符号表示)N>O>S>NaB、C、D三种元素的简单离子的半径由大到小的顺序(用离子符号表示)为S2->O2->Na+.
(4)许多金属盐都可以发生焰色反应(如元素C),其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布为msnmpn+2 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
| F | 基态F+各能级电子全充满 |
F元素在元素周期表中的位置为第四周期ⅠB族,F元素基态原子的外围电子排布图是
 .
.(2)B和C可形成一种同时含有共价键和离子键的化合物,其电子式为
 .
.(3)A、B、C、D四种元素第一电离能由大到小的顺序为(用元素符号表示)N>O>S>NaB、C、D三种元素的简单离子的半径由大到小的顺序(用离子符号表示)为S2->O2->Na+.
(4)许多金属盐都可以发生焰色反应(如元素C),其原因是激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量.
 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.