题目内容
8.CuO、Fe粉、Fe3O4的混合物中,加一定量稀硫酸,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后.取出铁钉,观察现象.以下结论中正确的是( )| A. | 若铁钉部分溶解,则滤液中一定含Fe2(SO4)3 | |
| B. | 若铁钉完全溶解,则滤液中一定含CuSO4 | |
| C. | 若铁钉表面有红色物质生成,则不溶物中一定不含Fe | |
| D. | 若铁钉无变化,则不溶物中一定含Fe |
分析 A.混合物中有固体剩余,则滤液中不含铁离子;
B.若铁钉完全溶解,不能判断溶液中是否有铜离子;
C.若铁钉表面有红色物质生成,说明溶液中有铜离子;
D.若铁钉无变化,说明溶液中没有铁离子和铜离子.
解答 解:A.混合物中有固体剩余,则滤液中不含铁离子,铁离子与Cu、Fe均能反应,不会有固体剩余,故A错误;
B.若铁钉完全溶解,不能判断溶液中是否有铜离子,溶液中有足量的氢离子时,铁钉完全溶解,故B错误;
C.若铁钉表面有红色物质生成,说明溶液中有铜离子,则固体中不能含有Fe,故C正确;
D.若铁钉无变化,说明溶液中没有铁离子和铜离子,不溶物中可能含有Fe,故D错误.
故选C.
点评 本题以氧化铜和铁与稀硫酸的反应为载体,考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序以及离子之间的反应分析.

练习册系列答案
相关题目
16.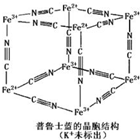 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
 普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A. | 化学式可以表示为KFe2(CN)6 | |
| B. | 每一个立方体中平均含有24个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个Fe3+周围与之相邻的Fe2+离子有12个 |
3.下列说法正确的是( )
| A. | 配制0.1mol/L CuSO4溶液100 mL,需称量CuSO4•5H2O 1.6g | |
| B. | 40g NaOH固体溶于1 L水,所得溶液的浓度为1 mol/L | |
| C. | 200mL 0.2mol/L MgCl2溶液中Cl-的个数为0.08NA | |
| D. | 从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为0.1 mol/L |
20.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中水的电离程度:①>③>② | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
17.不用任何试剂就能鉴别的一组物质是( )
| A. | Na2CO3和NaHCO3 | B. | Na2CO3和NaCl | C. | Na2CO3和盐酸 | D. | NaHCO3和盐酸 |
18.等质量的钠、镁、铝分别与足量的盐酸反应,产生H2的质量由大到小的排列顺序正确的是( )
| A. | Al、Mg、Na | B. | Mg、Al、Na | C. | Na、Mg、Al | D. | Na、Al、Mg |
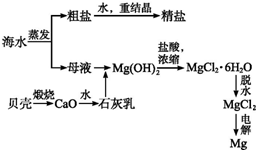 海水的综合利用可以制备金属镁,其流程如图所示:
海水的综合利用可以制备金属镁,其流程如图所示: 碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在人类生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.