题目内容
16.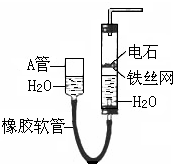 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:(1)图中,A管的作用是通过调节A管的高度,从而使右边的电石和水接触或分离,控制反应的发生和停止,制取乙炔的化学方程式是CaC2+2H2O→Ca(OH)2+CH≡CH↑.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是高锰酸钾溶液褪色,乙炔发生了氧化反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是溴的四氯化碳溶液褪色,
(4)为了安全,点燃乙炔前应检验纯度,乙炔燃烧时的实验现象是明亮火焰并伴有浓烈的黑烟.
(5)以乙炔、氯化氢为原料制取聚氯乙烯.写出反应的化学方程式:
CH≡CH+HCl$\stackrel{催化剂}{→}$CH2=CHCl,nCH2=CHCl$\stackrel{催化剂}{→}$
 .
.
分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生了氧化反应;
(3)关键乙炔与溴发生加成反应进行判断;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸;因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟;
(5)HC≡CH与HCl发生加成反应生成氯乙烯,氯乙烯发生加聚反应可生成聚氯乙烯.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:高锰酸钾溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,故答案为:溴的四氯化碳溶液褪色;
(4)乙炔燃烧的化学方程式为 2CH≡CH+5O2 $\frac{\underline{\;点燃\;}}{\;}$4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度,
故答案为:检验纯度;明亮火焰并伴有浓烈的黑烟;
(5)乙炔与HCl发生加成反应生成氯乙烯,再发生加聚反应,反应的化学方程式:CH≡CH+HCl$\stackrel{催化剂}{→}$CH2=CHCl;nCH2=CHCl$\stackrel{催化剂}{→}$ ,故答案为:CH≡CH+HCl$\stackrel{催化剂}{→}$CH2=CHCl;nCH2=CHCl$\stackrel{催化剂}{→}$
,故答案为:CH≡CH+HCl$\stackrel{催化剂}{→}$CH2=CHCl;nCH2=CHCl$\stackrel{催化剂}{→}$ .
.
点评 本题考查乙炔的实验室制法及其性质、化学方程式的书写,为高频考点,把握常见有机物的性质及反应类型为解答的关键,注意有机反应条件,题目难度不大.

| A. | 产生${\;}_{30}^{65}$Zn的反应是聚变反应 | |
| B. | ${\;}_{30}^{64}$Zn和${\;}_{30}^{65}$Zn具有相同的质子数 | |
| C. | ${\;}_{30}^{65}$Zn衰变放射出γ射线时,发生质量亏损,质量亏损并不意味着质量被消灭 | |
| D. | γ射线在真空中传播的速度是3.0×108m/s | |
| E. | γ射线是由于锌原子的内层电子激发产生的 |
①氯水放久了会逐渐由黄绿色变成几乎无色
②AgBr见光分解会生成浅黄色的银
③KI溶液中加入淀粉溶液会变成紫色
④碘水中加入CCl4振荡静置后,CCl4层紫红色
⑤氢气能在氯气中燃烧,火焰为黄色( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
| A. | C5H10 | B. | C4H8 | C. | C2H4 | D. | C2H4Cl2 |
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | Z和Y组成的物质是原子晶体 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
| A. | 加入NaOH溶液,生成灰白色沉淀迅速变成灰绿色,最后变成红褐色 | |
| B. | 加入NaOH溶液,生成红褐色沉淀 | |
| C. | 加入硫氰化钾溶液,显示红色 | |
| D. | 加入氨水,生成红褐色沉淀 |
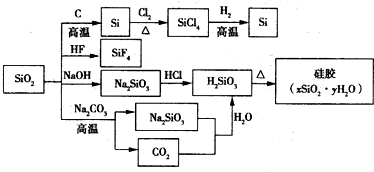
| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用玻璃塞 | |
| C. | 硅胶吸水后可重复再生 | |
| D. | 图中所示转化反应都是氧化还原反应 |
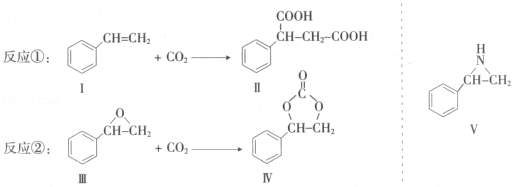
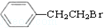 通过消去反应制备Ⅰ的化学方程式为
通过消去反应制备Ⅰ的化学方程式为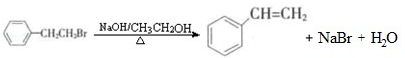 (注明反应条件).
(注明反应条件).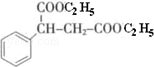 .
.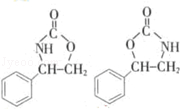 .
.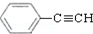 和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有AB(双选,填字母).
和H2三者发生反应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为C9H8O,且都能发生银镜反应.下列关于Ⅵ和Ⅶ的说法正确的有AB(双选,填字母).