题目内容
6.实验目的:为研究铁质材料与热浓硫酸的反应(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+若要确认其中是否含有Fe2+,应选择加入的试剂为d (选填序号)
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取672mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g.据此推知气体Y 中SO2的体积分数为66.7%.
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
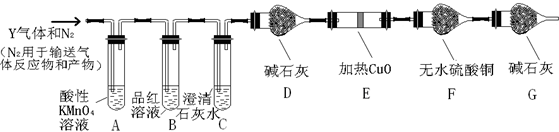
(2)气体Y中 还有H2的原因是浓硫酸变为稀硫酸,铁与稀硫酸反应生成氢气.
(3)装置A中试剂的作用是除去混合气体中的SO2,反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
(4)简述确认气体Y中含有CO2的实验现象B中品红溶液不褪色,C中石灰水变浑浊.
(5)如果气体Y中含有H2,预计实验现象应是E中黑色固体变红色,F中无水硫酸铜由白色变蓝色.
分析 (1)①Fe2+具有还原性,可与高锰酸钾发生氧化还原反应;
②根据反应的方程式SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,利用关系式法解答;
(2)铁钉放入浓硫酸中,加热,先生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应生成氢气;
(3)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,可用酸性高锰酸钾除去,为避免空气中水合二氧化碳进入F装置,G装置起到可吸收空气中的水和二氧化碳的作用;
(4)确认气体Y中含有CO2,应完全排除二氧化硫的干扰,根据二氧化硫的漂白性解答;
(5)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色;
解答 解:(1)①溶液为Fe3+和Fe2+离子的混合物,加入KSCN溶液和氯水、铁粉和KSCN溶液、浓氨水都不能检验亚铁离子的存在,亚铁离子具有还原性,高锰酸钾溶液呈紫色,具有氧化性,可与亚铁离子在酸性条件下反应二褪色,
故答案为:d;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,
所以硫酸钡和二氧化硫之间的关系式为SO2-----BaSO4,
设二氧化硫的体积为V,
SO2-----BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,所以二氧化硫的体积分数=$\frac{448mL}{672mL}$×100%=66.7%,
故答案为:66.7%;
(2)铁钉放入浓硫酸中,加热,先生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应生成氢气,所以气体Y中 还有H2,
故答案为:浓硫酸变为稀硫酸,铁与稀硫酸反应生成氢气;
(3)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫具有还原性,可与酸性高锰酸钾发生氧化还原反应,反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
故答案为:除去混合气体中的SO2;5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)确认气体Y中含有CO2,应完全排除二氧化硫的干扰,当B中品红溶液不褪色,C中石灰水变浑浊,可说明含有CO2,
故答案为:B中品红溶液不褪色,C中石灰水变浑浊;
(5)氢气具有还原性,能还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气,
故答案为:E中黑色固体变红色,F中无水硫酸铜由白色变蓝色.
点评 本题考查了浓硫酸的性质、二氧化硫的性质、常见物质的检验等知识点,注意二氧化碳和二氧化硫都能使澄清石灰水变浑浊,所以不能用澄清石灰水鉴别无色气体是二氧化碳还是二氧化硫,题目难度中等.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案| A. | (NH4)2SO4 | B. | HClO | C. | HNO3 | D. | AgNO3 |
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3NA | |
| C. | 0.2 mol Cl2溶解于等体积的水中,转移电子数为0.2NA | |
| D. | 标准状况下,11.2L 四氯化碳所含分子数为0.5NA |
| A. | Fe (OH)3 | B. | FeCl2 | C. | FeS | D. | Al(OH)3 |
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | Z和Y组成的物质是原子晶体 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
| A. |  | B. |  | C. |  | D. |  |
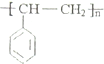 .根据所学知识,可以判断( )
.根据所学知识,可以判断( )| A. | 聚苯乙烯能使溴水褪色 | |
| B. | 聚苯乙烯是一种天然高分子化合物 | |
| C. | 聚苯乙烯可由苯乙烯通过化合反应制得 | |
| D. | 聚苯乙烯单体的分子式为C8H8 |