题目内容
20.一份NaOH溶液分成两等份后,分别用pH=2和pH=3的醋酸溶液完全中和,设消耗醋酸溶液的体积依次是Va L和Vb L,则Va和Vb之间的关系是( )| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
分析 醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大,根据含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,二者物质的量相等判断.
解答 解:含等量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,则有二者物质的量相等,因为所中和的氢氧化钠的物质的量是一定的,而醋酸是弱酸,醋酸为弱电解质,浓度越大,电离程度越小,pH为2和3的CH3COOH溶液,后者电离程度大,pH为2的CH3COOH的浓度大于pH为3的CH3COOH溶液的浓度的10倍,
设pH为2的醋酸浓度为x,PH=3的醋酸浓度为y,则有Va×x=Vb×y,
则$\frac{{V}_{a}}{{V}_{b}}$=$\frac{y}{x}$<$\frac{1}{10}$,即Vb>10Va,
故选D.
点评 本题考查酸碱混合的计算,题目难度中等,本题注意浓度不同的醋酸,电离程度不同,浓度越大,电离程度越小.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列物质中,不属于合金的是( )
| A. | 硬铝 | B. | 黄铜 | C. | 钢铁 | D. | 金箔 |
8.甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”、“=”或“<”).
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是BC
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是BC
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
15.根据能量变化示意图,下列热化学方程式正确的是( )
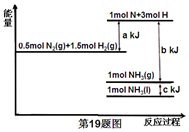

| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
5.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
9.下列有关金属钠的说法正确的是( )
| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | 将钠投入滴有紫色石蕊试液的水中,水溶液变为红色 | |
| C. | 将一小块钠放在CuSO4溶液中发生反应离子方程式:2Na+Cu2+═2Na++Cu | |
| D. | 将4.6gNa投入到95.4g水中,所得溶液中溶质的质量分数大于8.0% |
3.烟气中含有SO2等大量有害物质,烟气除硫的方法有很多,其中石灰石法烟气除硫工艺的主要反应如下
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(s)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成的石灰膏的热化学反应方程式2CaCO3(s)+2SO2(g)+O2(g)+4H2O(l)=2[CaSO4•2H2O](s)+2CO2△H=-681.8kJ/mol
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3个不同的容器中进行反应
A.容器保持恒温恒压 B.容器保持恒温恒容 C.容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的平均转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时说明该反应处于化学平衡状态
c.A,B两个容器达到平衡所用的时间tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下容器内SO2的质量如下表:
①在T1温度下,计算20-40min内SO2的反应速率2×10-5mol/(L.min)
②若其它条件都相同,则T1<T2(填“>”或“<”“=”下同):x>0.06
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等..
Ⅰ.CaCO3(s)?CO2(g)+CaO(s)△H=+178.2kJ/mol
Ⅱ.SO2(g)+CaO(s)?CaSO3(s)△H=-402kJ/mol
Ⅲ.2CaSO3(s)+O2(s)+4H2O(l)?2[CaSO4•2H2O](s)△H=-234.2kJ/mol
(1)试写出由石灰石、二氧化硫、氧气和水反应生成的石灰膏的热化学反应方程式2CaCO3(s)+2SO2(g)+O2(g)+4H2O(l)=2[CaSO4•2H2O](s)+2CO2△H=-681.8kJ/mol
(2)反应Ⅱ为烟气除硫的关键,取相同用量的反应物在3个不同的容器中进行反应
A.容器保持恒温恒压 B.容器保持恒温恒容 C.容器保持恒容绝热,且初始时3个容器的容积和温度均相同,下列说法正确的是ad
a.3个容器中SO2的平均转化率的大小顺序:aA>aB>aC
b.当A容器内气体的平均摩尔质量不变时说明该反应处于化学平衡状态
c.A,B两个容器达到平衡所用的时间tA>tB
d.当C容器内平衡常数不变时,说明该反应处于化学平衡状态
(3)依据反应Ⅱ来除硫,将一定量的烟气压缩到一个20L的容器中,测得不同温度下容器内SO2的质量如下表:
| 时间/min SO2质量/10-3g 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
②若其它条件都相同,则T1<T2(填“>”或“<”“=”下同):x>0.06
③在T2温度下,若平衡后将容器的容积压缩为10L,则新平衡时SO2的浓度=原平衡时SO2的浓度(填“>”“<”或“=”),理由是该反应的平衡常数表达式为k=$\frac{1}{c(S{O}_{2})}$,温度不变,平衡常数不变,所以浓度相等..
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+2H2O+S2-=S↓+2Na++4OH-.