题目内容
15.根据能量变化示意图,下列热化学方程式正确的是( )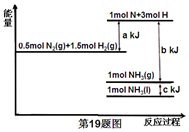
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
分析 焓变等于反应物断裂化学键吸收的能量减去形成化学键释放的能量,由图可知,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=(a-b)kJ•mol-1,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l)△H=(a-b-c)kJ•mol-1,结合物质的量与热量成正比、互为可逆反应的焓变的数值相同而符号相反来解答.
解答 解:由图可知,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g)△H=(a-b)kJ•mol-1,$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l)△H=(a-b-c)kJ•mol-1,则
A.N2(g)+3H2(g)=2NH3(g)△H=-2(b-a)kJ•mol-1,故A错误;
B.N2(g)+3H2(g)=2NH3(g)△H═-2(b-a)kJ•mol-1,故B错误;
C.物质的量与热量成正比、互为可逆反应的焓变的数值相同而符号相反,则2NH3(1)=N2(g)+3H2(g)△H=2(-a+b+c)kJ•mol-1,故C错误;
D.结合选项C可知,2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意可逆反应的焓变关系,题目难度不大.

练习册系列答案
相关题目
6.已知1gN2含a个分子,则阿伏加德罗常数为( )
| A. | $\frac{a}{14}$ mol-1 | B. | $\frac{a}{28}$ mol-1 | C. | 14a mol-1 | D. | 28a mol-1 |
20.一份NaOH溶液分成两等份后,分别用pH=2和pH=3的醋酸溶液完全中和,设消耗醋酸溶液的体积依次是Va L和Vb L,则Va和Vb之间的关系是( )
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
7.在一密闭容器中,反应m A(g)+n B(g)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.3mol/L.下列判断中正确的是( )
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增大 |
4.浓度均为0.1mol•L-1的下列各组溶液,pH前者大于后者的是( )
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |

 .
.