题目内容
9.下列有关金属钠的说法正确的是( )| A. | 钠在空气中燃烧生成氧化钠 | |
| B. | 将钠投入滴有紫色石蕊试液的水中,水溶液变为红色 | |
| C. | 将一小块钠放在CuSO4溶液中发生反应离子方程式:2Na+Cu2+═2Na++Cu | |
| D. | 将4.6gNa投入到95.4g水中,所得溶液中溶质的质量分数大于8.0% |
分析 A、钠在空气中燃烧生成过氧化钠;
B、钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性;
C、金属钠放入CuSO4溶液中,钠会先和H2O反应,生成的NaOH再与CuSO4反应;
D、钠投入到水中,发生根据反应的化学方程式分析生成NaOH的质量和溶液的质量,进而计算溶质的质量分数.
解答 解:A、钠在空气中燃烧生成过氧化钠,而不是氧化钠,故A错误;
B、钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色,不是红色,故B错误;
C、金属钠放入CuSO4溶液中,钠会先和H2O反应,生成的NaOH再与CuSO4反应,生成氢氧化铜,而不是单质铜,故C错误;
D、由于钠是活泼金属能与水发生2Na+2H2O=2NaOH+H2↑的反应,所以反应后生成的溶质设2.3克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y:
2Na+2H2O═2NaOH+H2↑
46 80 2
4.6g x y
则:$\frac{46}{4.6}=\frac{80}{x}=\frac{2}{y}$
解得x=8g;y=0.2g,
反应后所得溶液的质量分数:$\frac{8g}{4.6g+95.4g-0.2g}$×100%=8.02%,该值一定大于8%,故D正确;
故选D.
点评 本题考查钠的性质,其中选D通过回答本题知道了有的物质放入水中溶质会发生改变,此时的溶质的质量要根据方程式算出再进行计算.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.一份NaOH溶液分成两等份后,分别用pH=2和pH=3的醋酸溶液完全中和,设消耗醋酸溶液的体积依次是Va L和Vb L,则Va和Vb之间的关系是( )
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
17.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳与稀盐酸反应:H++OH-═H2O | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
4.浓度均为0.1mol•L-1的下列各组溶液,pH前者大于后者的是( )
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
14.下列叙述正确的是( )
| A. | 1 mol NH3的质量为17 g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 3.01×1023个O3分子和 3.01×1023个O2分子电子数之比等于1:1 | |
| D. | 等物质的量的CO2分子和CO分子的质量比等于11:7 |
1.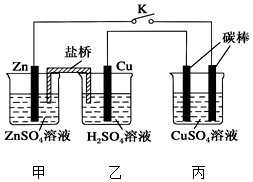 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
12. 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
(1)下表为几种共价键的键能.
则上述丙烷裂解反应的△H=+123KJ/mol
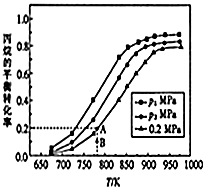
(2)在密闭容器中充入一定量的丙烷和适量的稀有气体,测得丙烷的平衡转化率随温度的变化关系如图所示.
①图中压强p1<(填“>”“<”或“=”,下同)p2;
②B点在0.2Mpa及对应温度下,v(正)>v(逆).
③图中A点的平衡常数K=8.33KPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④提高丙烷转化率的措施是升温(任填一种)
(3)丙烷在脱氢生成丙烯时还会生成乙烯,该副反应的化学方程式为C3H8$\stackrel{催化剂}{→}$C2H4+CH4;
(4)近年来研究人员采用了添加二氧化碳重整丙烷制取丙烯,其原理为C3H8(g)+CO2(g)?C3H6(g)+CO(g)+H2O(g),有关数据如表所示.
不同温度下C3H8脱氢反应的平衡转化率
①二氧化碳重整丙烷制取丙烯的反应属于吸热(填“放热”或“吸热”)反应.
②从表中数据可知,最合适的$\frac{n(C{O}_{2})}{n({C}_{3}{H}_{8})}$=1:3.
③二氧化碳重整法相对于丙烷直接裂解脱氢制丙烯的优点是可以提高丙烷的转化率,可以将二氧化碳资源化利用的同时得到燃气.
 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:(1)下表为几种共价键的键能.
| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
(2)在密闭容器中充入一定量的丙烷和适量的稀有气体,测得丙烷的平衡转化率随温度的变化关系如图所示.
①图中压强p1<(填“>”“<”或“=”,下同)p2;
②B点在0.2Mpa及对应温度下,v(正)>v(逆).
③图中A点的平衡常数K=8.33KPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
④提高丙烷转化率的措施是升温(任填一种)
(3)丙烷在脱氢生成丙烯时还会生成乙烯,该副反应的化学方程式为C3H8$\stackrel{催化剂}{→}$C2H4+CH4;
(4)近年来研究人员采用了添加二氧化碳重整丙烷制取丙烯,其原理为C3H8(g)+CO2(g)?C3H6(g)+CO(g)+H2O(g),有关数据如表所示.
不同温度下C3H8脱氢反应的平衡转化率
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
②从表中数据可知,最合适的$\frac{n(C{O}_{2})}{n({C}_{3}{H}_{8})}$=1:3.
③二氧化碳重整法相对于丙烷直接裂解脱氢制丙烯的优点是可以提高丙烷的转化率,可以将二氧化碳资源化利用的同时得到燃气.