题目内容
8.甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是BC
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
分析 (1)分析反应特征可知平衡常数K3=K1×K2,计算不同温度下反应③的平衡常数,结合温度变化分析判断反应焓变△H<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2;依据某时刻浓度商计算和平衡常数比较判断反应进行的方向;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
解答 解:(1)反应③3H2(g)+CO2(g)═CH3OH(g)+H2O(g)是气体体积减小的反应△S<0,依据反应①+②得到反应③,所以平衡常数K3=K1×K2,结合温度变化分析,随温度升高,平衡常数减小,平衡逆向进行,所以判断反应是放热反应,焓变△H<0,在500℃、2L的密闭容器中,进行反应③,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,Q=$\frac{0.15×0.3}{0.{8}^{3}×0.1}$=0.87<K=2.5,反应正向进行,V正>V逆,
故答案为:K1•K2;>;
(2)A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1,不能判断正逆反应速率是否相等,无法判断是否达到平衡状态,故A错误;
B.该反应是体积减小的反应,容器内压强保持不变,表明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故B正确;
C.H2的消耗速率与CH3OH的消耗速率之比为3:1,表示的是正逆反应速率,且满足计量数关系,说明达到了平衡状态,故C正确;
D.容器内的密度保持不变,反应方程式两边都是气体,气体的总质量不变,容器的容积固定,所以反应过程中气体的密度始终不变,所以密度不能作为判断平衡状态的依据,故D错误;
故选BC.
点评 本题考查了化学平衡状态的判断、本题考查了化学平衡影响因素分析判断、平衡移动的方向的判断等,题目综合性强,涉及的知识点较多,充分考查了学生对书写知识的掌握与理解,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案反应A:4HCl+O2 $\frac{\underline{\;催化剂\;}}{△}$2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量.
II.
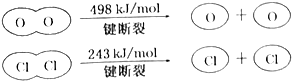
判断下列说法正确的是( )
| A. | 反应A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O键比HCl中H-Cl键弱 | |
| C. | 由II中的数据判断氯元素的非金属性比氧元素强 | |
| D. | 断开1molH-O键与断开1molH-Cl键所需能量相差31.9kJ |
①其它条件不变时,缩小容器体积,平衡H2(g)+I2(g)?2HI(g)不移动,体系颜色不变
②常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存
③将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
④为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸.
| A. | 全错 | B. | 只有④正确 | C. | ①③④正确 | D. | ①②③正确 |
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳与稀盐酸反应:H++OH-═H2O | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |