题目内容
5.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤对电子 | |
| C. | 向反应后的溶液加入乙醇,溶液没有发生变化 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
分析 氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液.
A.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
B.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
C.络合物在乙醇中溶解度较小,所以会析出;
D.氢氧化铜和氨水反应生成配合物而使溶液澄清.
解答 解:A.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物而使溶液澄清,所以溶液中铜离子浓度减小,故A错误;
B.在[Cu(NH3)4]2+离子中,中心原子Cu2+提供空轨道,配位体NH3提供孤电子对,故B正确;
C.[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体,故C错误;
D.硫酸铜和氨水反应生成氢氧化铜蓝色沉淀,继续加氨水时,氢氧化铜和氨水继续反应生成络合物离子[Cu(NH3)4]2+而使溶液澄清,故D正确.
故选BD.
点评 本题考查了配合物、配位键的形成等性质,难度不大,明确形成配合物的条件是:有提供空轨道的中心原子,有提供孤电子对的配位体.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
15.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于表:
①该可逆反应的平衡常数的表达式为K=c2(NH3)c(CO2)
②可以判断该分解反应已经达到平衡的是BD.
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下增大容器体积,氨基甲酸铵固体的质量将减少(填“增加”、“减少”或“不变”).
④该反应的焓变△H>0(填“>”、“=”或“<”,下同),熵变△S>0
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.0kJ•mol-1
请写出CO与SO2反应的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ•mol-1.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)实验测得不同温度下的平衡数据列于表:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
②可以判断该分解反应已经达到平衡的是BD.
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下增大容器体积,氨基甲酸铵固体的质量将减少(填“增加”、“减少”或“不变”).
④该反应的焓变△H>0(填“>”、“=”或“<”,下同),熵变△S>0
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
②CO2(g)+C(s)═2CO(g)△H2=+172.5kJ•mol-1
③S(s)+O2(g)═SO2(g)△H3=-296.0kJ•mol-1
请写出CO与SO2反应的热化学方程式2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270.0kJ•mol-1.
16.下列叙述正确的是( )
①其它条件不变时,缩小容器体积,平衡H2(g)+I2(g)?2HI(g)不移动,体系颜色不变
②常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存
③将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
④为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸.
①其它条件不变时,缩小容器体积,平衡H2(g)+I2(g)?2HI(g)不移动,体系颜色不变
②常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存
③将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
④为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸.
| A. | 全错 | B. | 只有④正确 | C. | ①③④正确 | D. | ①②③正确 |
20.一份NaOH溶液分成两等份后,分别用pH=2和pH=3的醋酸溶液完全中和,设消耗醋酸溶液的体积依次是Va L和Vb L,则Va和Vb之间的关系是( )
| A. | Va>10Vb | B. | Vb=10Va | C. | Vb<10Va | D. | Vb>10Va |
17.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 石灰乳与稀盐酸反应:H++OH-═H2O | |
| C. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
14.下列叙述正确的是( )
| A. | 1 mol NH3的质量为17 g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 3.01×1023个O3分子和 3.01×1023个O2分子电子数之比等于1:1 | |
| D. | 等物质的量的CO2分子和CO分子的质量比等于11:7 |
8.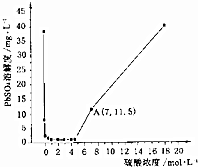 已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
 已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )
已知25℃时KSP(PbSO4)=1.6×10-8、KSP(BaSO4)=1.1×10-10,该温度下PbSO4在不同浓度的硫酸中的溶解度如图所示.下列有关说法不正确的是( )| A. | 图中A点c(SO42-)=7mol•L-1 | |
| B. | 过滤的PbSO4沉淀,用稀硫酸洗涤,可以减少沉淀损耗 | |
| C. | 硫酸浓度大于5mol•L-1时,PbSO4溶解度增大的原因是转化成Pb(HSO4)2 | |
| D. | 将Pb(NO3)2、Ba(NO3)2混合溶液滴入稀硫酸中,能生成PbSO4和BaSO4两种沉淀 |