题目内容
11.下列离子方程式错误的是( )| A. | NaHSO3溶液显酸性是因为:HSO3-+H2O?SO32-+H3O+ | |
| B. | 尼泊金酸(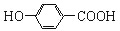 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: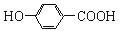 +2HCO3-→ +2HCO3-→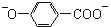 +CO2↑+2H2O +CO2↑+2H2O | |
| C. | KAl(SO4)2溶液中加入少量氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 足量硫酸氢钠溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
分析 A.电离显酸性;
B.只有-COOH与碳酸氢钠反应;
C.加入少量氢氧化钠,生成氢氧化铝沉淀;
D.氢氧化钡完全反应,生成硫酸钡、水、硫酸钠.
解答 解:A.NaHSO3溶液显酸性是因为存在电离方程式为HSO3-+H2O?SO32-+H3O+,故A正确;
B.尼泊金酸( )与碳酸氢钠溶液反应的反应为
)与碳酸氢钠溶液反应的反应为 +HCO3-→
+HCO3-→ +CO2↑+H2O,故B错误;
+CO2↑+H2O,故B错误;
C.KAl(SO4)2溶液中加入少量氢氧化钠溶液的离子反应为Al3++3OH-═Al(OH)3↓,故C正确;
D.足量硫酸氢钠溶液与氢氧化钡溶液混合的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D正确;
故选B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、电离反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1molCl2作为反应物,转移电子数一定为2NA | |
| B. | 1molC9H20中含有共价键数目为28NA | |
| C. | 标况下448mL二氯甲烷中含有分子数为0.02NA | |
| D. | 常温常压下,1.8 g重水(D2O)中含中子数为NA |
2.已知KHC2O4溶液显酸性,向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是( )
| A. | c(K+)=c(HC2O4-)+c(H2C2O4)+2c(C2O42-) | B. | c(Na+)=c(H2C2O4)+c(C2O42-) | ||
| C. | c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-) | D. | c(K+)>c(Na+) |
19.在人类已知的化合物中,品种最多的是( )
| A. | 元素周期表里属于过渡元素的化合物 | |
| B. | 位于元素周期表里第ⅡA族元素的化合物 | |
| C. | 位于元素周期表里第ⅢA族元素的化合物 | |
| D. | 位于元素周期表里第ⅣA族元素的化合物 |
6.如图所示,甲、乙两装置中除了铁片与铜片是否用导线连接外,其余均完全相同.若实验同时开始进行,当反应相同的时间时(反应均未停止),忽略电解质溶液的体积变化,则两装置中仍相同的是( )

| A. | 铁片的质量 | B. | 铜片的质量 | ||
| C. | 生成氢气的体积(同温同压) | D. | H+的物质的量浓度 |
3.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 46g NO2和N2O4以任意比混合,所得混合气体中氧原子数2NA | |
| B. | 标准状况下,含NA个共价键的HF分子所占的体积约为22.4 L | |
| C. | 1mol Fe 与一定量的硝酸反应,转移的电子数为0.2NA~0.3NA | |
| D. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数小于2NA |
10.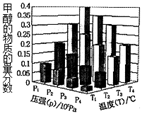 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T1>T3 | D. | P1>P4 T2<T3 |
8.当冰醋酸固体变成液体或气体时,一定发生变化的是( )
| A. | 分子内化学键 | B. | 共价键键能 | C. | 分子的构型 | D. | 分子间作用力 |
 营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.
营养均衡有利于身体健康.某品牌高钙梳打的配料标签如图所示.