题目内容
6.如图所示,甲、乙两装置中除了铁片与铜片是否用导线连接外,其余均完全相同.若实验同时开始进行,当反应相同的时间时(反应均未停止),忽略电解质溶液的体积变化,则两装置中仍相同的是( )
| A. | 铁片的质量 | B. | 铜片的质量 | ||
| C. | 生成氢气的体积(同温同压) | D. | H+的物质的量浓度 |
分析 铁比铜活泼,铁与稀硫酸反应生成氢气,甲与乙相比较,乙形成原电池反应,生成氢气的速率较大,以此解答该题.
解答 解:甲与乙相比较,乙形成原电池反应,生成氢气的速率较大,则在相同时间内,乙消耗铁片的质量较大,生成氢气的体积较大,H+的物质的量浓度变化较大,因铜与稀硫酸不反应,则甲、乙装置铜片的质量都不变,
故选B.
点评 本题考查原电池以及反应速率的比较,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,难度不大.

练习册系列答案
相关题目
16.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2S全部溶于水所得溶液中HS-和S2-离子数之和为NA | |
| B. | 含4mol HCl的浓盐酸与足量二氧化锰反应转移的电子总数为2NA | |
| C. | 11g T2O含有的电子数为5NA | |
| D. | 常温下,0.2L 0.5mol/L NH4NO3溶液的氮原子数小于0.2NA |
17.一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示.下列说法错误的是( )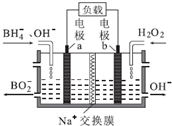

| A. | 电池的正极反应为H2O2+2e-=2OH- | |
| B. | 电池放电时Na+从a极区移向b极区 | |
| C. | 电子从电极b经外电路流向电极a | |
| D. | b极室的输出液经处理后可输入a极室循环利用 |
14.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A. | 加水稀释2倍后,两溶液的pH均减小 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加适量的醋酸钠晶体后,盐酸pH增大,醋酸pH不变 | |
| D. | 加足量的锌充分反应后,醋酸产生的氢气比盐酸多 |
1.下列电子式书写正确的是( )
| A. | 硫化钠的形成过程: | B. | CCl4: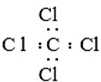 | ||
| C. | 氮气:N:N: | D. | 二氧化碳: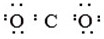 |
11.下列离子方程式错误的是( )
| A. | NaHSO3溶液显酸性是因为:HSO3-+H2O?SO32-+H3O+ | |
| B. | 尼泊金酸(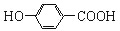 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: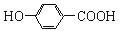 +2HCO3-→ +2HCO3-→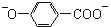 +CO2↑+2H2O +CO2↑+2H2O | |
| C. | KAl(SO4)2溶液中加入少量氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 足量硫酸氢钠溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
5.等质量的下列物质燃烧,消耗氧气量最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H6 | D. | C3H8 |
2.在氧、氟、钠、氯四种元素中,原子半径最大的元素是( )
| A. | 氧 | B. | 氟 | C. | 钠 | D. | 氯 |
3.1,2-二氯乙烯可以形成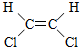 与
与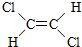 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
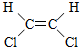 与
与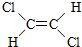 两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,下列物质中,能形成类似上述两种空间异构体的是( )| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 2-丁烯 | D. | 1-丁烯 |