题目内容
为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案.
方案一 准确称量样品m g,与水充分反应后将溶液的体积稀释为V mL,从中取出V1 mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用指示剂是 .
方案二 准确称量样品m g,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.
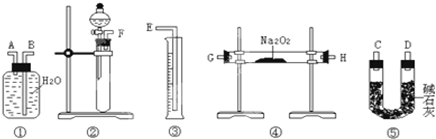
(2)该方案的实验过程中,仪器的连接顺序是 (填仪器下方序号),仪器①中的进气口为 (填“A”或“B”).
(3)装置⑤的作用是 .
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案 .
方案一 准确称量样品m g,与水充分反应后将溶液的体积稀释为V mL,从中取出V1 mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)此方案中,酸碱中和滴定时应选用指示剂是
方案二 准确称量样品m g,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.

(2)该方案的实验过程中,仪器的连接顺序是
(3)装置⑤的作用是
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案
考点:探究物质的组成或测量物质的含量,钠的重要化合物
专题:实验探究和数据处理题
分析:(1)酸碱中和滴定时,可用酚酞或甲基橙做指示剂;
(2)测定某含有杂质Na2O的Na2O2样品的纯度,根据过氧化钠与二氧化碳反应生成氧气,通过碱石灰吸收过量的二氧化碳和水蒸气,通过排水量气装置测定氧气的体积,结合化学方程式定量关系计算过氧化钠的质量,进而计算含量;
(3)根据碱石灰能吸收二氧化碳分析;
(4)根据过氧化钠与水反应生成氧气,判定过氧化钠的质量,进而计算含量.
(2)测定某含有杂质Na2O的Na2O2样品的纯度,根据过氧化钠与二氧化碳反应生成氧气,通过碱石灰吸收过量的二氧化碳和水蒸气,通过排水量气装置测定氧气的体积,结合化学方程式定量关系计算过氧化钠的质量,进而计算含量;
(3)根据碱石灰能吸收二氧化碳分析;
(4)根据过氧化钠与水反应生成氧气,判定过氧化钠的质量,进而计算含量.
解答:
解:(1)酸碱中和滴定时,可用酚酞或甲基橙做指示剂,滴定终点溶液盐酸由红色变为无色,或由黄色变为橙色,
故答案为:酚酞(甲基橙);
(2)测定某含有杂质Na2O的Na2O2样品的纯度,方法是利用装置②制备二氧化碳气体,把生成的二氧化碳气体通过装置④与过氧化钠充分反应,生成的气体通过装置⑤盛碱石灰的干燥管,除去二氧化碳和水蒸气,用装置①③排水法测量氧气的体积,根据氧气的体积便可知样品中过氧化钠的质量,排水法测定氧气的体积时,导管应短进长出.
故答案为:②④⑤①③;A;
(3)氧气中混有二氧化碳气体,为准确测量生成的氧气的体积,应用碱石灰吸收二氧化碳,
故答案为:除去O2中混有的CO2等气体;
(4)如果可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,可将样品与水反应,用排水法的量生成氧气的体积,
故答案为:将样品与过量水反应,测产生O2的体积.
故答案为:酚酞(甲基橙);
(2)测定某含有杂质Na2O的Na2O2样品的纯度,方法是利用装置②制备二氧化碳气体,把生成的二氧化碳气体通过装置④与过氧化钠充分反应,生成的气体通过装置⑤盛碱石灰的干燥管,除去二氧化碳和水蒸气,用装置①③排水法测量氧气的体积,根据氧气的体积便可知样品中过氧化钠的质量,排水法测定氧气的体积时,导管应短进长出.
故答案为:②④⑤①③;A;
(3)氧气中混有二氧化碳气体,为准确测量生成的氧气的体积,应用碱石灰吸收二氧化碳,
故答案为:除去O2中混有的CO2等气体;
(4)如果可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,可将样品与水反应,用排水法的量生成氧气的体积,
故答案为:将样品与过量水反应,测产生O2的体积.
点评:本题考查物质的组成和含量的测量,题目较为综合,难度较大,注意把握实验方案的设计原理.

练习册系列答案
相关题目
将0.2mol?L-1的偏铝酸钠溶液和0.4mol?L-1的盐酸等体积混合,混合液中离子浓度由大到小的顺序是( )
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )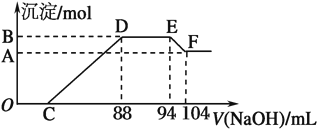

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
对下列实验的描述正确的是( )
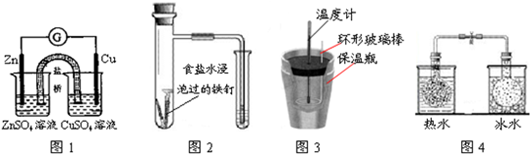

| A、图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 |
| B、图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C、图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
| D、图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是放热反应 |
关于小药箱中常备药物的作用叙述错误的是( )
| A、板蓝根冲剂用于预防感冒 |
| B、氟哌酸用于退热止痛 |
| C、阿司匹林用于退热解痛 |
| D、胃舒平用于抑酸止胃痛 |

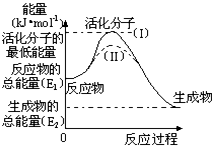 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.