题目内容
将0.3mol氯化铝和11.1g氯化钙组成的混合物溶于水配成200ml溶液,此溶液中Cl-的物质的量浓度是多少?Cl-的质量是多少?
考点:物质的量浓度的相关计算
专题:
分析:混合物中氯离子的物质的量是二者中氯离子物质的量的和,根据n=
以及物质的量浓度公式c=
来计算即可.
| m |
| M |
| n |
| V |
解答:
解:0.3mol氯化铝中含有氯离子的物质的量是0.9mol,11.1g氯化钙的物质的量是
=0.1mol,其中氯离子的物质的量是0.2mol,二者组成的混合物中含有的氯离子的物质的量是0.9mol+0.2mol=1.1mol,溶于水配成200ml溶液,此溶液中Cl-的物质的量浓度是
=5.5mol/L,氯离子的质量是1.1mol×35.5g/mol=39.05g,答:溶液中Cl-的物质的量浓度是5.5mol/L,Cl-的质量是39.05g.
| 11.1g |
| 111g/mol |
| 1.1mol |
| 0.2L |
点评:本题考查学生物质的量浓度的计算知识,注意计算公式的灵活使用是解题的关键,难度中等.

练习册系列答案
相关题目
将0.2mol?L-1的偏铝酸钠溶液和0.4mol?L-1的盐酸等体积混合,混合液中离子浓度由大到小的顺序是( )
| A、[Cl-]>[Al3+]>[Na+]>[H+]>[OH-] |
| B、[Cl-]>[Na+]>[Al3+]>[H+]>[OH-] |
| C、[Cl-]>[Al3+]>[Na+]>[OH-]>[H+] |
| D、[Na+]>[Cl-]>[Al3+]>[OH-]=[H+] |
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )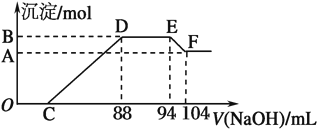

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
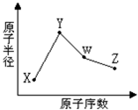 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
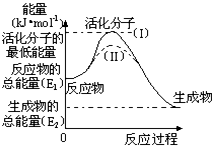 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察如图,然后回答问题.