题目内容
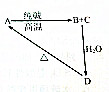 几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.
几种含硅物质的相互转化关系如图所示,其中物质A是一种高熔点化合物,不溶于稀硫酸、硝酸,却溶于氢氟酸;C是一种气体;D是白色胶状沉淀.(1)写出化学式:A
(2)写出化学方程式:
①A→B+C:
②使A中的元素由化合态变为游离态:
考点:无机物的推断
专题:
分析:A是一种高熔点的化合物,不溶于硫酸、硝酸,却溶于氢氟酸,则A为SiO2;A与纯碱反应生成硅酸钠与二氧化碳,而C是一种气体,则C为CO2,B为Na2SiO3,D是白色胶状沉淀,则D为H2SiO3,据此解答.
解答:
解:A是一种高熔点的化合物,不溶于硫酸、硝酸,却溶于氢氟酸,则A为SiO2;A与纯碱反应生成硅酸钠与二氧化碳,而C是一种气体,则C为CO2,B为Na2SiO3,D是白色胶状沉淀,则D为H2SiO3,
(1)由上述分析可知,A、B、C、D分别为SiO2、Na2SiO3、CO2、H2SiO3,故答案为:SiO2;Na2SiO3;CO2;H2SiO3;
(2)①A→B+C化学方程式为SiO2+Na2CO3
Na2SiO3+CO2↑,
B+C+H2O→D离子方程式为SiO32-+CO2+H2O═H2SiO3↓+CO32-或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,
故答案为:SiO2+Na2CO3
Na2SiO3+CO2↑;SiO32-+CO2+H2O═H2SiO3↓+CO32-或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;
②使A中的元素由化合态变为游离态,反应方程式为:SiO2+2C
Si+2CO↑,
故答案为:SiO2+2C
Si+2CO↑.
(1)由上述分析可知,A、B、C、D分别为SiO2、Na2SiO3、CO2、H2SiO3,故答案为:SiO2;Na2SiO3;CO2;H2SiO3;
(2)①A→B+C化学方程式为SiO2+Na2CO3
| ||
B+C+H2O→D离子方程式为SiO32-+CO2+H2O═H2SiO3↓+CO32-或SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,
故答案为:SiO2+Na2CO3
| ||
②使A中的元素由化合态变为游离态,反应方程式为:SiO2+2C
| ||
故答案为:SiO2+2C
| ||
点评:本题考查无机物的推断,侧重硅及其化合物性质及转化的考查,关键是根据A的性质推断其为二氧化硅,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
硝酸发生氧化还原反应时,硝酸浓度越稀,对应还原产物中氮元素化合价越低,现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐渐加入5mol/LNaOH溶液,所加NaOH溶液的体积(ml)与产生沉淀的物质的量(mol)关系如图所示.则下列叙述错误的是( )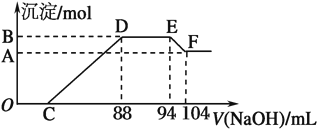

| A、DE段方程式为NH4++OH-=NH3?H2O |
| B、原硝酸溶液中含硝酸的物质的量为0.47 mol |
| C、C点对应的溶液体积为40 mL |
| D、混合物中铝粉与铁粉的物质的量之比为5:3 |
下列叙述正确的是( )
| A、吸滤完毕或中途需停止吸滤时,应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管 |
| B、在层析实验操作中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| C、要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们制成热饱和溶液,降温后再过滤 |
| D、由于碘在酒精中的溶解度大,故可用酒精把碘水中的碘萃取出来 |
 (1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
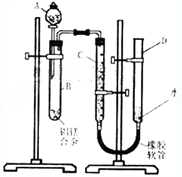 某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.