题目内容
3.下列电池工作时,负极上有H2参与反应的是( )| A. |  氢燃料电池 | B. |  锌锰碱性电池 | C. |  铅蓄电池 | D. |  银锌纽扣电池 |
分析 由选项可知,只有氢氧燃料电池的负极上氢气失去电子,参与反应,以此来解答.
解答 解:A.氢燃料电池,负极上H2参与反应,失去电子被氧化,故A选;
B.锌锰碱性电池,负极上Zn失去电子,故B不选;
C.铅蓄电池,负极上Pb失去电子生成硫酸铅,故C不选;
D.银锌纽扣电池,负极上Zn失去电子,故D不选;
故选A.
点评 本题考查原电池,为高频考点,把握电极判断、电极反应为解答的关键,侧重分析与应用能力的考查,注意常见的化学电源的工作原理,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13. 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:
第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
①下列能判断该反应达到平衡的是C
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
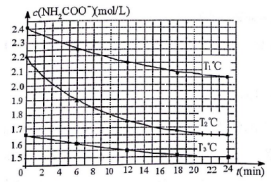
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
14.对于强碱性条件的甲醇燃料电池,下列说法正确的是( )
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
11.中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果.我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”.下列有关叙述正确的是( )
| A. | ①中水银“积变又还成丹砂”说明水银发生了还原反应 | |
| B. | ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu | |
| C. | 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒 | |
| D. | 水银能跟曾青发生置换反应生成单质铜 |
18.各指定粒子数目不等于阿伏加德罗常数值的是( )
| A. | 1g H2 所含的原子个数 | |
| B. | 4g 氦气所含的原子个数 | |
| C. | 23g 金属 Na 全部转变为金属离子时失去的电子个数 | |
| D. | 16g O2 所含的分子个数 |
8.现有常温下pH=2的醋酸溶液,下列有关叙述正确的是( )
| A. | c(H+)=c(CH3COO-) | |
| B. | 醋酸的物质的量浓度为0.01mol•L-1 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈碱性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
15.在2L密闭容器中加热0.1molN2O5,发生反应:N2O5(g)?N2O3(g)+O2(g),N2O3(g)?N2O(g)+O2(g).达到平衡时,n(N2O3)为0.02mol,n(02)为0.14mol,则c(N2O)为( )
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
6. 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |