题目内容
5.下列物质中,不属于电解质的是( )| A. | NaOH | B. | H2SO4 | C. | SO2 | D. | NaCl |
分析 电解质:在水溶液中或熔融状态下能够导电的化合物;
非电解质:在熔融状态和水溶液中都不能导电的化合物.
解答 解:A.NaOH是化合物,在水溶液中或熔融状态下能够导电,属于电解质,故A不选;
B.H2SO4是化合物,在水溶液中能够导电,属于电解质,故B不选,
C.二氧化硫在水溶液中与水反应生成亚硫酸,亚硫酸电离出自由移动的离子导电,二氧化硫自身不能电离,二氧化硫是非电解质,故C选;
D.NaCl是化合物,在水溶液中或熔融状态下能够导电,属于电解质,故D不选;
故选C.
点评 本题考查电解质、非电解质概念的辨析,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列说法正确的是 ( )
| A. | 强电解质溶液一定比弱电解质溶液的导电性强 | |
| B. | 强电解质的稀溶液中不存在溶质分子 | |
| C. | 弱电解质不一定都是共价化合物 | |
| D. | 不同的弱电解质只要物质的量浓度相同,电离程度就相同 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
13. 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:
第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
①下列能判断该反应达到平衡的是C
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
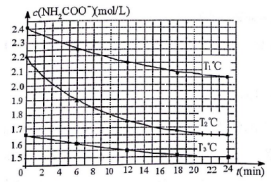
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
 工业上合成尿素(H2NCONH2)分为两步:
工业上合成尿素(H2NCONH2)分为两步:第一步,将液态氨气与气态CO2化合得到氨基甲酸铵(H2NCOONH4);
第二步,将氨基甲酸铵分解得到尿素:
H2NCOONH4(l)?H2O(1)+H2NCONH2 (1)△H1═+226.3kJ•mol-1.
(1)已知总反应的热化学方程式为:2NH3(l)+CO2(g)?H2O(1)+H2NCONH2 (1)△H2=-103.7kJ•mol-1.
①下列能提高尿素产率的措施是B.
A.升温 B.加压 C.添加催化剂
②写出第一步反应的热化学方程式2NH3(l)+CO2(g)?H2NCOONH4(l)△H=-330.0kJ•mol-1.
(2)已知:NH2COONH4(s)?2NH3(g)+CO2(g).某实验小组在一固定容积的密闭容器中加入NH2COONH4(s)进行实验,以探究外界因素对化学平衡移动的影响,记录了下列数据.
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.2v正(NH3)═v逆(CO2) B.密闭容器中氨气的体积分数不变
C.密闭容器中气体总浓度不变 D.混合气体的平均相对分子质量不变
②25.0℃与15.0℃时的平衡常数之比是8.
③上表实验的目的是探究温度对化学平衡的影响,通过数据分析得出的结论是升高温度平衡正向进行,正反应为吸热反应.
(3)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
①计算T3℃时,0~12min氨基甲酸铵水解反应的平均速率0.0083mol/(L•min) (保留2位有效数字).
②比较图中T1、T2的大小:T1<T2(填“>”、“=”或“<”),判断的理由是T2℃反应物起始浓度比T1°C小,但相同时间内0-6min的平均反应速率仍比T1°C时的大.
20.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | CO2通入NaClO 溶液中能生成HClO |
| B | 根据溶液的pH与溶液碱性的关系 | pH=6.8的溶液一定显酸性 |
| C | 组成和结构相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 同主族元素从上至下非金属性减弱 | HF、HCl、HBr、HI的酸性依次减弱 |
| A. | A | B. | B | C. | C | D. | D |
10.同温同压下,等质量的甲烷(CH4)和N2O两种气体相比较,下列叙述中正确的( )
| A. | 物质的量之比为1:1 | B. | 密度之比为4:11 | ||
| C. | 体积之比为4:11 | D. | 原子数之比为5:3 |
17.下列有关有机化合物结构和性质的说法正确的是( )
| A. | 乙烯、苯和乙酸均能发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,它可使酸性 KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图)最多能与含5mol NaOH的水溶液完全反应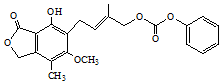 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
14.对于强碱性条件的甲醇燃料电池,下列说法正确的是( )
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
15.在2L密闭容器中加热0.1molN2O5,发生反应:N2O5(g)?N2O3(g)+O2(g),N2O3(g)?N2O(g)+O2(g).达到平衡时,n(N2O3)为0.02mol,n(02)为0.14mol,则c(N2O)为( )
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |