题目内容
6.下列各组离子能大量共存的是( )| A. | 无色溶液中:Na+、Cu2+、NO3-、Cl- | |
| B. | 在pH=4的溶液中:Na+、K+、OH-、Cl- | |
| C. | 在含Ba2+的溶液中:H+、Na+、Cl-、SO42- | |
| D. | 与Fe反应产生气体的溶液:Na+、K+、Cl-、SO42- |
分析 A.有颜色的离子不能大量共存;
B.pH=4的溶液呈酸性;
C.与Ba2+反应的离子不能大量共存;
D.与Fe反应产生气体的溶液呈酸性.
解答 解:A.Cu2+有颜色,不能大量共存,故A错误;
B.pH=4的溶液呈酸性,OH-不能大量共存,故B错误;
C.SO42-与Ba2+反应,不能大量共存,故C错误;
D.与Fe反应产生气体的溶液呈酸性,酸性条件下离子之间不发生任何反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 20gD2O含有的质子数为10NA | |
| B. | 1molNa2O2与足量水反应转移的电子数为NA,生成的气体的标况下的体积为22.4L | |
| C. | 1L0.1mol/LHF溶液中含有共价键数目为0.1NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
17.下列有关有机化合物结构和性质的说法正确的是( )
| A. | 乙烯、苯和乙酸均能发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,它可使酸性 KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图)最多能与含5mol NaOH的水溶液完全反应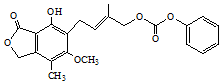 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
14.对于强碱性条件的甲醇燃料电池,下列说法正确的是( )
| A. | 负极反应式:CH3OH-8e-+8OH-=CO2+6H2O | |
| B. | 电池工作时,CH3OH发生还原反应,被氧化 | |
| C. | 电池工作时,溶液中的阴离子向负极移动 | |
| D. | 电池工作一段时间后,溶液的pH增大 |
11.中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果.我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”; ②“以曾青涂铁,铁赤色如铜”.下列有关叙述正确的是( )
| A. | ①中水银“积变又还成丹砂”说明水银发生了还原反应 | |
| B. | ②中反应的离子方程式为:2Fe+3Cu2+=2Fe3++3Cu | |
| C. | 根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒 | |
| D. | 水银能跟曾青发生置换反应生成单质铜 |
18.各指定粒子数目不等于阿伏加德罗常数值的是( )
| A. | 1g H2 所含的原子个数 | |
| B. | 4g 氦气所含的原子个数 | |
| C. | 23g 金属 Na 全部转变为金属离子时失去的电子个数 | |
| D. | 16g O2 所含的分子个数 |
15.在2L密闭容器中加热0.1molN2O5,发生反应:N2O5(g)?N2O3(g)+O2(g),N2O3(g)?N2O(g)+O2(g).达到平衡时,n(N2O3)为0.02mol,n(02)为0.14mol,则c(N2O)为( )
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
10.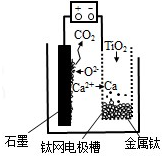 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )| A. | 将熔融CaF2-CaO 换成Ca 处理也可以达到相同目的 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb 电极 |