题目内容
1. 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做量热计.
(2)下列△H表示物质燃烧热的是△H4、△H5;表示物质中和热的是△H6.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)═2H2O(l)△H1B.C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3 D.C(s)+O2(g)═CO2(g)△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H7
H.CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H8
(3)已知在101kPa、273k时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是C.
A.C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=+2akJ/mol
B.C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-2akJ/mol
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=-4akJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-2akJ/mol
(4)充分燃烧一定量的丁烷放出的热量为161.9kJ,生成的CO2恰好与5mol/L 100mLkOH溶液完全反应生成正盐,则燃烧1mol丁烷放出的热量为2590.4kJ.
(5)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单地理解为断开1mol化学键时所需吸收的能量.表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能kJ/mol | 197 | 360 | 499 | x |
分析 (1)测量反应热的常用仪器为量热计;
(2)燃烧热指1mol物质完全燃烧生成稳定的氧化物的反应热,一般H→H2O(l)、C→CO2(g)、S→SO2(g),中和热指稀溶液中酸与碱反应生成1molH2O的反应热热量;
(3)在25℃、101kPa下,15g乙烷完全燃烧生成CO2和液态水,放热a kJ,30g乙烷燃烧生成CO2和液态水时放热a kJ×2=2akJ,1mol乙烷质量为30克,所以完全燃烧1mol乙烷生成二氧化碳和液态水放热2aKJ,根据燃烧热的概念分析即可解答;
(4)CO2恰好与KOH溶液完全反应生成正盐为K2CO3,根据n=cV计算KOH的物质的量,根据钾元素守恒计算n(K2CO3),根据碳元素守恒由n(CO2)=n(K2CO3),进而计算丁烷的物质的量,据此计算;
(5)根据反应热等于反应物的总键能与生成物的总键能之差,结合反应热计算键能.
解答 解:(1)用于测定物质的热容及各种反应热的仪器,叫量热计,也称量热仪、量热器,
故答案为:量热计;
(2)A.氢气的物质的量为2mol,反应热△H1不能表示燃烧热;
B.碳燃烧的生成物为CO,表示温度的氧化物CO2,反应热△H2不能表示燃烧热;
C.1mol甲烷完全燃烧,生成的水是气态,不是稳定的状态,应为液态水,故反应热△H3不能表示燃烧热;
D.C(s)+O2(g)═CO2(g)△H4中1molC完全燃烧生成二氧化碳,符合燃烧热概念,反应热△H4能表示燃烧热;
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5中1molC6H12O6完全燃烧生成二氧化碳与液态水,符合燃烧热概念,反应热△H5能表示燃烧热;
F.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6中实质是1mol氢离子与1mol氢氧根离子反应生成1molH2O,符合中和热概念,反应热△H6能表示中和热;
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7反应生成的水为2mol,反应热△H7不能表示中和热;
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)中,醋酸是弱酸,不能表示中和热.
故答案为:△H4、△H5;△H6;
(3)A.C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l);△H1=+2a kJ/mol在热化学反应方程式中△H>0,表示吸热,而C2H6燃烧反应是放热反应,故A错误;
B.C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g);△H2=-2a kJ/mol,完全燃烧1mol乙烷生成二氧化碳和液态水放热2akJ,该方程式表示的是气态水,故B错误;
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故C正确;
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol,完全燃烧2mol乙烷生成二氧化碳和液态水放热4akJ,故D错误;
故选:C.
(4)KOH的物质的量为0.1L×5mol/L=0.5mol,根据钾离子守恒,故n(K2CO3)=0.5mol×$\frac{1}{2}$=0.25mol,
根据碳元素守恒由n(CO2)=n(K2CO3)=0.25mol,
根据碳元素守恒可知,丁烷的物质的量n(C4H10)=$\frac{1}{4}$×0.25mol,放出热量161.9kJ,
所以1mol丁烷完全燃烧放出的热量为161.9kJ×16=2590.4kJ,
故答案为:2590.4kJ;
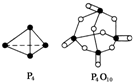
(5)白磷燃烧的热化学方程式为P4(s)+5O2(g)═P4O10(s)△H=-2378.0kJ/mol,
则6×197kJ/mol+5×499kJ/mol-12×360kJ/mol-4X=-2378kJ/mol,
X=433.75kJ/mol,
故答案为:433.75.
点评 本题考查较为综合,涉及燃烧热与中和热的概念、反应热的有关计算、热化学方程式的意义等,注意中和热与燃烧热概念的把握,难点是白磷、P4O10结构及键能计算反应热,题目难度中等.

| A. | 乙烯、苯和乙酸均能发生加成反应 | |
| B. | 某芳香烃的分子式为C10H14,它可使酸性 KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种 | |
| C. | 1 mol的有机物(结构如图)最多能与含5mol NaOH的水溶液完全反应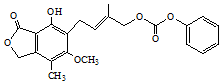 | |
| D. | 油脂皂化反应得到高级脂肪酸与甘油 |
| A. | 1g H2 所含的原子个数 | |
| B. | 4g 氦气所含的原子个数 | |
| C. | 23g 金属 Na 全部转变为金属离子时失去的电子个数 | |
| D. | 16g O2 所含的分子个数 |
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
| A. | 加入铝粉有大量氢气产生的溶液中:Ca2+、K+、NO3-、Cl- | |
| B. | PH=0的无色溶液中:Na+、K+、MnO4-、NO3- | |
| C. | 在0.1mol/L的盐酸中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在含有大量Fe3+的溶液中:NH4+、Ca2+、Cl-、K+ |
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
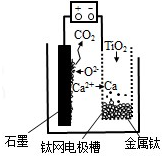 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )| A. | 将熔融CaF2-CaO 换成Ca 处理也可以达到相同目的 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb 电极 |
| A. | 单质:金刚石、白磷 | B. | 酸性氧化物:SO3、CO2、NO | ||
| C. | 混合物:铝热剂、矿泉水、焦炉气 | D. | 同素异形体:C60、C70、金刚石 |