题目内容
19.取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )| A. | 0.01 mol/L | B. | 0.07 mol/L | C. | 0.05 mol/L | D. | 0.50 mol/L |
分析 酸碱混合后,pH=12,则碱过量,剩余的c(OH-)=0.01mol/L,以此来计算.
解答 解:设NaOH和HCl的物质的量浓度均为x,NaOH和HCl溶液以3:2体积比相混合,体积分别为3V、2V,
酸碱混合后,pH=12,则碱过量,剩余的c(OH-)=0.01mol/L,
则$\frac{3V×x-2V×x}{5V}$=0.01mol/L,
解得x=0.05mol/L,
故选C.
点评 本题考查酸碱混合的计算,明确混合后pH=12为碱过量是解答本题的关键,并注意pH与浓度的换算来解答,题目难度不大.

练习册系列答案
相关题目
15.在2L密闭容器中加热0.1molN2O5,发生反应:N2O5(g)?N2O3(g)+O2(g),N2O3(g)?N2O(g)+O2(g).达到平衡时,n(N2O3)为0.02mol,n(02)为0.14mol,则c(N2O)为( )
| A. | 0.07mol•L-1 | B. | 0.06 mol•L-1 | C. | 0.04 mol•L-1 | D. | 0.03 mol•L-1 |
10.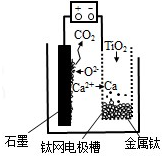 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO 作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )| A. | 将熔融CaF2-CaO 换成Ca 处理也可以达到相同目的 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO 的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb 电极 |
4.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| B. | 当镀铜铁制品的镀层破损时,镀层仍能对铁制品起保护作用 | |
| C. | 铁制品长期与氯化铵溶液接触,易发生吸氧腐蚀 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
11.分类是重要的科学研究方法,下列物质分类错误的是( )
| A. | 单质:金刚石、白磷 | B. | 酸性氧化物:SO3、CO2、NO | ||
| C. | 混合物:铝热剂、矿泉水、焦炉气 | D. | 同素异形体:C60、C70、金刚石 |
8.工业上,可用硫酸铈溶液吸收尾气中NO,其化学方程式如下:2NO+3H2O+4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4下列说法正确的是( )
| A. | 在该反应中氧化剂与还原剂的物质的量之比为1:2 | |
| B. | 在该反应中,氧化产物有两种,还原产物有一种 | |
| C. | 若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大 | |
| D. | 在该反应中,每消耗22.4LNO必转移2 mol电子 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| B. | 在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 | |
| C. | 含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA | |
| D. | 标准状况下,1molNa2O2的体积是22.4L |