题目内容
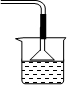
11.CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)?H3CuCl4(aq).(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O═2CuCl43-+SO${\;}_{4}^{2-}$+4H+
CuCl43-(aq)?CuCl(s)+3Cl-(aq)
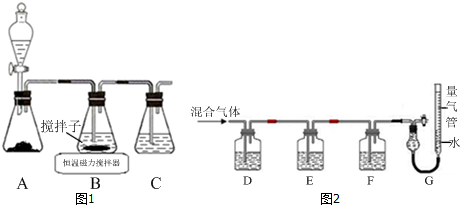
①装置C的作用是吸收SO2尾气,防止污染空气.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物$→_{i}^{冷却}$$→_{ii}^{倒入溶有SO_{2}的水中}$$→_{iii}^{过滤}$$→_{iv}^{洗涤}$$→_{v}^{干燥}$CuCl晶体
操作ⅱ的主要目的是促进CuCl析出、防止CuCl被氧化
操作ⅳ中最好选用的试剂是水、稀盐酸或乙醇.
③实验室保存新制CuCl晶体的方法是避光、密封保存.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:将固体溶于浓盐酸后过滤,取滤液加入大量水,过滤、洗涤、干燥.
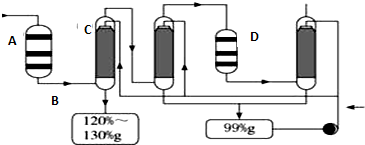
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是氢氧化钡溶液、CuCl的盐酸溶液.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:2S2O42-+3O2+4OH-=4SO42-+2H2O.
分析 (1)①A装置中制备二氧化硫,根据二氧化硫有毒、污染空气角度分析;
②倒入溶有二氧化硫的溶液有利于CuCl析出,二氧化硫具有还原性,可防止CuCl被氧化;根据CuCl难溶于水、稀盐酸和乙醇分析;
③由于CuCl见光分解、露置于潮湿空气中易被氧化,据此判断保存方法;
④利用浓盐酸溶解CuCl生成H3CuCl4,过滤分离,再用水稀释后过滤分离;
(2)氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积,据此进行解答.
解答 解:(1)①A装置制备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气,
故答案为:吸收SO2尾气,防止污染空气;
②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以防止CuCl被氧化;CuCl难溶于水、稀盐酸和乙醇,可以用水、稀盐酸或乙醇洗涤,减小因溶解导致的损失,
故答案为:促进CuCl析出、防止CuCl被氧化;水、稀盐酸或乙醇;
③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存,
故答案为:避光、密封保存;
④提纯某混有铜粉的CuCl晶体实验方案:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl,
故答案为:将固体溶于浓盐酸后过滤,取滤液加入大量水,过滤、洗涤、干燥;
(2)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积,
故答案为:氢氧化钡溶液;CuCl的盐酸溶液;
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O,
故答案为:2S2O42-+3O2+4OH-=4SO42-+2H2O.
点评 本题考查物质制备实验方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,试题侧重考查学生对信息获取与迁移运用,有利于提高学生的分析、理解能力及化学实验能力.

| A. | 混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | |
| C. | 加入AgNO3溶液时首先生成AgCl沉淀 | |
| D. | 混合溶液中$\frac{c(C{l}^{-})}{c({I}^{-})}$约为1.03×10-3 |
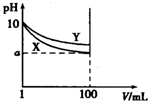 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸 的体积Vx>Vy | |
| D. | 若8<a<10,则X、Y都是弱碱 |
| A. | NaCl晶体与冰 | B. | 石英与干冰 | C. | 金刚石与KCl晶体 | D. | 冰与干冰 |
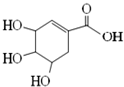
| A. | 分子式为C7H8O5 | |
| B. | 分子中含有2种官能团,可发生加成、酯化反应 | |
| C. | 其同分异构体中可能含酯基和醛基,不可能含有苯环 | |
| D. | 该化合物与足量的 Na、NaOH反应得到的钠盐产物相同 |
 .
.


 .
. ;
; .
.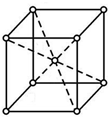 X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1.
X、Y、Z、W四种元素是周期表前四周期元素,X元素原子核外有16种不同运动状态的电子,Y的原子序数比X大1,Z原子的M能层上有4个未成对电子,W的价层电子排布式为ndn+5(n+1)sn-1. ;W元素的名称为镍.
;W元素的名称为镍.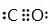 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.