题目内容
1.前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,D原子核外电子有8种不同的运动状态,E是用途最广泛的金属,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.(1)E元素在周期表中的位置第四周期第Ⅷ族;F+的电子排布式为1s22s22p63s23p63d10.
(2)化合物BD(CA2)2中,B原子的杂化方式为sp2杂化,1mol该分子中σ键数目为7NA个,该物质易溶于水的主要原因是与H2O形成分子间氢键.
(3)ACD3中阴离子CD3-的空间构型为平面三角形.
(4)根据等电子体原理,BD分子的电子式为
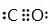 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.(5)将F单质粉末加入到CA3的浓溶液中,并通入D2,充分反应后溶液呈深蓝色,写出该反应的化学方程式2Cu+8NH3?H2O+O2═2[Cu(NH3)4](OH)2+6H2O.
分析 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,则A为H元素;B的最简单气态氢化物能引起温室效应,则B为碳元素;D原子核外电子有8种不同的运动状态,则D为O元素;C的原子序数介于碳、氧之间,则C为N元素;E是用途最广泛的金属,则E为Fe;F元素的基态原子最外能层只有一个电子,其它能层均已充满电子,核外电子数为2+8+18+1=29,故F为Cu.
解答 解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,则A为H元素;B的最简单气态氢化物能引起温室效应,则B为碳元素;D原子核外电子有8种不同的运动状态,则D为O元素;C的原子序数介于碳、氧之间,则C为N元素;E是用途最广泛的金属,则E为Fe;F元素的基态原子最外能层只有一个电子,其它能层均已充满电子,核外电子数为2+8+18+1=29,故F为Cu.
(1)E为Fe元素,在周期表中的位置:第四周期第Ⅷ族,Cu+的电子排布式为:1s22s22p63s23p63d10,
故答案为:第四周期第Ⅷ族;1s22s22p63s23p63d10;
(2)化合物CO(NH2)2中,碳原子形成3个σ键,没有孤对电子,杂化轨道数目为3,故碳原子的杂化方式为sp2杂化,1mol该分子中σ键为7mol,即含有7NA个σ键,该物质易溶于水的主要原因是:与H2O形成分子间氢键,
故答案为:sp2杂化;7NA;与H2O形成分子间氢键;
(3)阴离子NO3-中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,故其空间构型为 平面三角形,
故答案为:平面三角形;
(4)根据等电子体原理,CO分子与N2分子互为等电子体,而结构相似,则CO的电子式为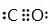 ,Fe与CO形成的化合物Fe(CO)5熔点253K,沸点376K,熔沸点比较低,符合分子晶体性质,其固体属于分子晶体,
,Fe与CO形成的化合物Fe(CO)5熔点253K,沸点376K,熔沸点比较低,符合分子晶体性质,其固体属于分子晶体,
故答案为: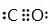 ;分子;
;分子;
(5)将Cu单质粉末加入到NH3的浓溶液中,并通入O2,充分反应后溶液呈深蓝色,该反应的化学方程式:2Cu+8NH3?H2O+O2═2[Cu(NH3)4](OH)2+6H2O,
故答案为:2Cu+8NH3?H2O+O2═2[Cu(NH3)4](OH)2+6H2O.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、化学键、氢键、等电子体、晶体类型与性质、配合物等,是对物质结构主干知识的综合考查,需要学生具备扎实的基础.

 名校课堂系列答案
名校课堂系列答案| A. | x=4 | B. | B的转化率为60% | ||
| C. | A的平衡浓度是2.8mol/L | D. | 平衡时气体的压强是原来的0.94倍 |
| A. | 加入少量W,逆反应速率增大 | |
| B. | 通入一定量氦气,压强增大,平衡向正反应方向移动 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
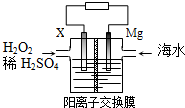
| A. | X可为铁、铜、石墨等电极 | |
| B. | 每转移2 mol电子,2mol H+由交换膜左侧向右侧迁移 | |
| C. | 正极的电极反应式为H2O2+2e-+2H+═2H2O | |
| D. | 该电池能将化学能全部转化成电能 |
| A. | 熔融的氯化钠 | B. | CO2 | C. | 食盐水 | D. | Fe |
 氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.
氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.