题目内容
1.已知25℃时,AgI饱和溶液中c(Ag+)为1.23×10-8 mol•L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol•L-1.若在5mL含有KCl和KI各为0.01mol•L-1的溶液中,加入8mL 0.01mol•L-1 AgNO3溶液,下列叙述正确的是( )| A. | 混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | |
| B. | 混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | |
| C. | 加入AgNO3溶液时首先生成AgCl沉淀 | |
| D. | 混合溶液中$\frac{c(C{l}^{-})}{c({I}^{-})}$约为1.03×10-3 |
分析 因为Ksp(AgI)<Ksp(AgCl),则加硝酸银先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol•L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol•L-1×8×10-3L-5.0×10-5 mol=3.0×10-5 mol,而KCl为n(KCl)=0.01mol•L-1×5×10-3L=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,以此来解答.
解答 解:因为Ksp(AgI)<Ksp(AgCl),则加硝酸银先生成AgI,再生成AgCl,AgNO3+KI═AgI↓+KNO3,n(KI)=0.01mol•L-1×5 mL=5.0×10-5 mol,消耗n(AgNO3)=5.0×10-5mol,AgNO3+KCl═AgCl↓+KNO3,过量的AgNO3为0.01 mol•L-1×8×10-3L-5.0×10-5 mol=3.0×10-5 mol,而KCl为n(KCl)=0.01mol•L-1×5×10-3L=5.0×10-5 mol,则KCl过量,生成AgCl为3.0×10-5 mol,由此得出反应后溶液中的溶质为KNO3、KCl,
A.由上述分析可知,反应后溶液中的溶质为KNO3、KCl,生成AgCl、AgI沉淀,离子浓度顺序为c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故A错误;
B.离子浓度大小为c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-),故B正确;
C.因为Ksp(AgI)<Ksp(AgCl),则加硝酸银先生成AgI,故C错误;
D.混合溶液中$\frac{c(C{l}^{-})}{c({I}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgI)}$=$\frac{(1.25×1{0}^{-5})^{2}}{(1.23×1{0}^{-8})^{2}}$=1.03×10-6,故D错误;
故选B.
点评 本题考查难溶电解质及相关计算,为高频考点,把握AgI先生成、离子反应及离子浓度比较为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案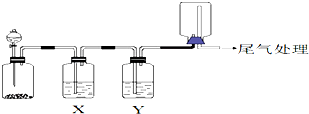
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
| C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| D | 氨水与生石灰反应制取并收集纯净干燥的NH3 | 饱和NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2 L乙醇蒸气含共价键数目为4NA | |
| C. | 1mol K与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L 0.2 mol•L-1 NH4ClO4溶液中含NH4+数目为0.2NA |
| A. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH ) | |
| B. | 在常温下,10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10 | |
| C. | 将pH=3的一元弱酸HA和pH=11的NaOH溶液充分混合后一定有:c(OH-)<c(H+)<c(Na+)<c(A-) | |
| D. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
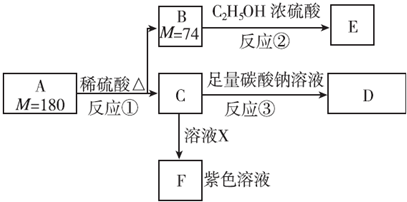
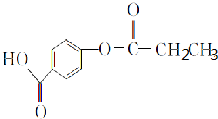 ,1 mol A与足量NaOH溶液反应的化学方程式为
,1 mol A与足量NaOH溶液反应的化学方程式为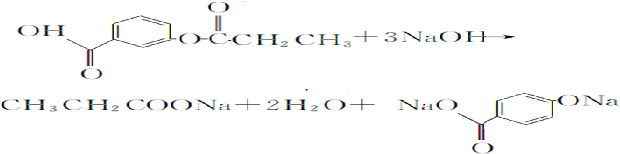 .
.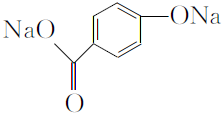 .
.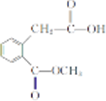 和
和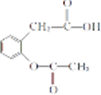 ,.
,. 科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)
科学研究表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO) .
.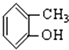 ⑥
⑥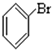 ⑦
⑦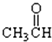 ⑧
⑧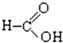 ⑨
⑨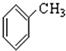 ⑩
⑩