题目内容
20.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )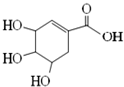
| A. | 分子式为C7H8O5 | |
| B. | 分子中含有2种官能团,可发生加成、酯化反应 | |
| C. | 其同分异构体中可能含酯基和醛基,不可能含有苯环 | |
| D. | 该化合物与足量的 Na、NaOH反应得到的钠盐产物相同 |
分析 该分子中含有醇羟基、碳碳双键和羧基,具有醇、烯烃和羧酸性质,能发生氧化反应、消去反应、加成反应、加聚反应、酯化反应、取代反应等,据此分析解答.
解答 解:A.根据结构简式确定分子式为C7H10O5,故A错误;
B.该分子中含有醇羟基、碳碳双键和羧基三种官能团,故B错误;
C.该分子的不饱和度是3,苯环的不饱和度是4,所以该分子的同分异构体中可能含有酯基和醛基,不可能含有苯环,故C正确;
D.能和钠反应的有醇羟基和羧基,只有羧基能和NaOH反应,所以该化合物与足量的钠、NaOH反应得到的钠盐产物不同,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,侧重考查醇和羧酸性质,注意该分子中没有酚羟基,易错选项是C.

练习册系列答案
相关题目
10.硅及其化合物在材料领域中应用广泛,下列叙述中不正确的是( )
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
8.某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.
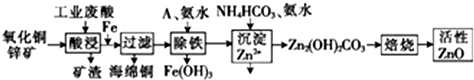
已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气搅拌外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<(填“>”“<”或“=”)Ksp(ZnS).
(3)物质A最好使用下列物质中的B.
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(5)物质B是可直接用作氮肥的正盐,则B的化学式是(NH4)2SO4.
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.7 |
| Zn2+ | 6.2 | 8.0 |
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气搅拌外,还可采取的措施是适当升高温度(或增大酸浓度、将氧化铜锌矿粉碎等)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<(填“>”“<”或“=”)Ksp(ZnS).
(3)物质A最好使用下列物质中的B.
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在3.2~6.2范围之间.
(5)物质B是可直接用作氮肥的正盐,则B的化学式是(NH4)2SO4.
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.
5.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如表:
(1)请写出铝热反应的化学反应方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:合理(填“合理”或“不合理”).请写出铝热反应的一种工业用途焊接钢轨、冶炼难熔金属、定向爆破.
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室要溶解该熔融物,下列试剂中可以选用BC(填序号).
A.浓硫酸 B.稀硫酸C.稀硝酸 D.氢氧化钠溶液.
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:合理(填“合理”或“不合理”).请写出铝热反应的一种工业用途焊接钢轨、冶炼难熔金属、定向爆破.
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室要溶解该熔融物,下列试剂中可以选用BC(填序号).
A.浓硫酸 B.稀硫酸C.稀硝酸 D.氢氧化钠溶液.
12.在2 L密闭容器中将4 mol气体A和2 mol气体B混合,在一定温度下发生反应:3A(g)+2B(g)?xC(g)+2D(g).2min后达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol/(L•min),下列说法正确的是( )
| A. | x=4 | B. | B的转化率为60% | ||
| C. | A的平衡浓度是2.8mol/L | D. | 平衡时气体的压强是原来的0.94倍 |
10.交通运输部在南海华阳礁举行华阳灯塔和赤灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用.灯塔可用镁海水电池提供能源,其装置如图所示.下列有关海水电池的说法正确的是( )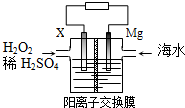

| A. | X可为铁、铜、石墨等电极 | |
| B. | 每转移2 mol电子,2mol H+由交换膜左侧向右侧迁移 | |
| C. | 正极的电极反应式为H2O2+2e-+2H+═2H2O | |
| D. | 该电池能将化学能全部转化成电能 |
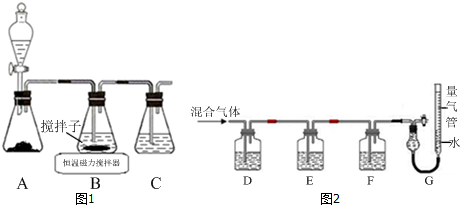
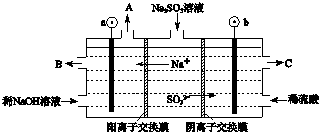
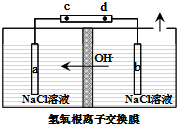 氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.
氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.