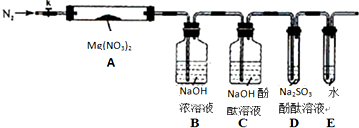
题目内容
2.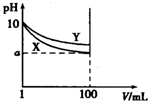 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | X、Y两种碱溶液中溶质的物质的量浓度一定相等 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性强 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸 的体积Vx>Vy | |
| D. | 若8<a<10,则X、Y都是弱碱 |
分析 根据图象曲线变化及信息可知,两种碱溶液具有相同的体积和pH;稀释过程中pH变化越大,其碱性越强;当a=8时,说明x为强碱,若8<a<10,说明X、Y都属于弱碱,据此进行解答.
解答 解:A.由图可知,开始的pH相同,两种碱溶液稀释后pH不同,则碱性强弱一定不同,所以物质的量浓度一定不相等,故A错误;
B.稀释后X碱溶液pH小于Y溶液的,所以稀释后Y溶液碱性强,故B错误;
C.由图象可知100mL的溶液中n(OH-)关系为Y>X,说明pH=10的X、Y两种碱溶液,溶质浓度Y大于X,完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX<VY,故C错误;
D.由图可知,开始的pH相同,若8<a<10,则1mL的弱碱加水稀释到100mL,则pH会在原来基础上减一个小于2的值,说明X、Y中都存在电离平衡,都属于弱碱,故D正确;
故选D.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确弱电解质的电离平衡及其影响为解答结构,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
13.下列叙述中正确的是( )
| A. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH ) | |
| B. | 在常温下,10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10 | |
| C. | 将pH=3的一元弱酸HA和pH=11的NaOH溶液充分混合后一定有:c(OH-)<c(H+)<c(Na+)<c(A-) | |
| D. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
10.硅及其化合物在材料领域中应用广泛,下列叙述中不正确的是( )
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
14.下列分子中键角不是120°的是( )
| A. | C2H4 | B. | C6H6 | C. | BF3 | D. | NH3 |
12.在2 L密闭容器中将4 mol气体A和2 mol气体B混合,在一定温度下发生反应:3A(g)+2B(g)?xC(g)+2D(g).2min后达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol/(L•min),下列说法正确的是( )
| A. | x=4 | B. | B的转化率为60% | ||
| C. | A的平衡浓度是2.8mol/L | D. | 平衡时气体的压强是原来的0.94倍 |
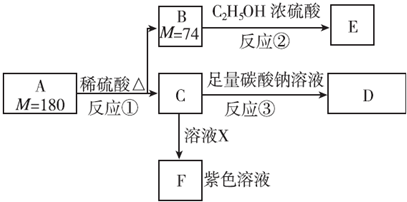
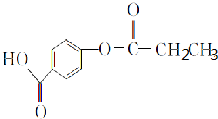 ,1 mol A与足量NaOH溶液反应的化学方程式为
,1 mol A与足量NaOH溶液反应的化学方程式为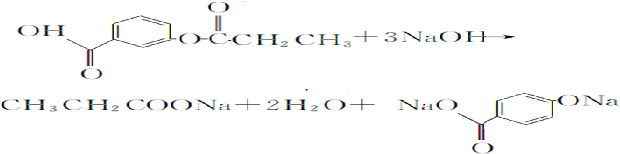 .
.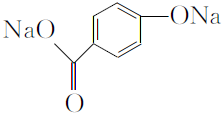 .
.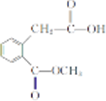 和
和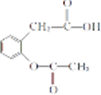 ,.
,.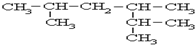
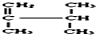 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;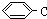 ≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个. 表示的分子式C6H14.
表示的分子式C6H14.