题目内容
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA |
| B、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| C、常温常压下,92g NO2和N2O4混合气体中含有的原子数为6NA |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5NA |
考点:阿伏加德罗常数
专题:
分析:A、根据N=
NA结合阴离子的电子数来计算;
B、标况下,氯仿即三氯甲烷为液态;
C、根据NO2和N2O4气体的最简式计算出含有的原子数;
D、电解时,比铜活泼的金属先溶解.
| m |
| M |
B、标况下,氯仿即三氯甲烷为液态;
C、根据NO2和N2O4气体的最简式计算出含有的原子数;
D、电解时,比铜活泼的金属先溶解.
解答:
解:A、一个超氧根离子中含有17个电子,35.5g超氧化钾(KO2)的物质的量是0.5mol,所以35.5g超氧化钾(KO2)所含阴离子中的电子数为8.5×6.02×1023,故BA错误;
B、标况下,氯仿即三氯甲烷为液态,故B错误;
C、NO2和N2O4气体的最简式为NO2,92g混合物中含有2mol最简式NO2,含有6mol原子,含有的原子数为6NA,故C正确;
D、电解法精炼铜时,粗铜作阳极,发生的反应有:Zn-2e-=Zn2+,Fe-2e-=Fe2+,Ni-2e-=Ni2+,Cu-2e-=Cu2+,可见每转移1mol电子时阳极上溶解的铜必小于0.5 NA,故D错误.
故选C.
B、标况下,氯仿即三氯甲烷为液态,故B错误;
C、NO2和N2O4气体的最简式为NO2,92g混合物中含有2mol最简式NO2,含有6mol原子,含有的原子数为6NA,故C正确;
D、电解法精炼铜时,粗铜作阳极,发生的反应有:Zn-2e-=Zn2+,Fe-2e-=Fe2+,Ni-2e-=Ni2+,Cu-2e-=Cu2+,可见每转移1mol电子时阳极上溶解的铜必小于0.5 NA,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
向三份0.lmol/L NaHCO3溶液中分别加入少量冰醋酸、Ca(OH)2、NaA1O2固体(忽略溶液体积变化),则溶液中CO32-浓度的变化依次为( )
| A、减小、减小、增大 |
| B、减小、增大、增大 |
| C、增大、减小、减小 |
| D、减小、减小、减小 |
将反应Zn+Br2=ZnBr2设计成蓄电池,则下列有关说法不正确的是( )
| A、充电时,阳极的电极反应式为:2Br--2e-=Br2 |
| B、放电时,负极的电极反应式为:Zn-2e-=Zn2+ |
| C、放电时,Zn2+ 移向负极 |
| D、电解质溶液不可以用强碱,也不可以用强酸 |
2007年6月20日,新浪网报道了中国矿业大学发生的铊中毒事件.铊(Tl)在元素周期表中与铝处于同一主族,与铯(Cs)处于同一周期.下列有关说法正确的是( )
A、
| ||||
B、
| ||||
| C、Tl3+核外有6个电子层 | ||||
| D、Tl原子半径大于Cs原子半径 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A、2.4g 镁作还原剂时失去电子数是0.1×6.02×1023 |
| B、标准状况下,22.4L 氮气中含有的共价键数是6.02×1023 |
| C、标准状况下,5.6 L的甲醛所含的电子数是4×6.02×1023 |
| D、100mL 1mol/L氨水溶液中,铵根离子的个数0.1×6.02×1023 |
下列反应的离子方程式书写正确的是( )
| A、过量的铁与浓硝酸反应:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
| B、1mol?L-1的NaAlO2溶液和2.5mol?L-1 的盐酸等体积混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| C、在碳酸氢镁溶液中加入足量 Ca(OH)2 溶液:Mg2++2HCO3-+Ca2++2OH-═MgCO3↓+CaCO3↓+2H2O |
| D、H2O中投入Na218O2固体:2H2O+218O22-═418OH-+O2↑ |
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物.下列说法正确的是( )
| A、34S原子核内中子数为16 |
| B、在相同条件下1H216O比1H218O更易气化 |
| C、13C和15N原子核内的质子数相差2 |
| D、2H+的酸性比1H+的酸性更强 |
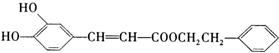 )是一种天然抗癌药物,在一定条件下能发生如下转化:
)是一种天然抗癌药物,在一定条件下能发生如下转化: