题目内容
16.下列溶液一定显酸性的是( )| A. | pH<7的溶液 | B. | c(H+)>c(OH-) 的溶液 | ||
| C. | c(H+)=1×10-7mol•L-1 | D. | c(H+)=c(OH-) 的溶液 |
分析 溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小,如果c(OH+)<c(H+),则溶液呈酸性,如果c(OH+)=c(H+)则溶液呈中性,溶液c(OH+)>c(H+),则溶液呈碱性.
解答 解:A.溶液PH和溶液温度有关,pH<7的溶液不一定呈酸性,故A错误;
B.溶液中c(OH+)<c(H+),则溶液一定呈酸性,故B正确;
C.常温下,pH>7的溶液为碱性溶液,c(H+)=1×10-7mol•L-1 ,溶液呈中性,温度不知不能确定溶液酸碱性,故C错误;
D.c(H+)=c(OH-) 的溶液一定显示中性,故D错误;
故选B.
点评 本题考查了水的电离、溶液酸碱性的判断,明确溶液的酸碱性取决于溶液中c(OH+)、c(H+)的相对大小是解本题的关键,难度不大.

练习册系列答案
相关题目
8.常温时,下列说法正确的是( )
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
7.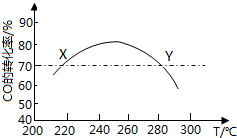 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H<0 | |
| C. | 反应温度应控制在260℃~280℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
4.下列说法正确的是( )
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
8.下列物质属于纯净物的是( )
| A. | 漂白粉 | B. | 水玻璃 | C. | CuSO4•5H2O | D. | Fe(OH)3胶体 |
5.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色.
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图 .
.
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程: .
.
(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为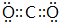 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为 .
.
(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为
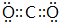 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为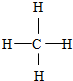 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.
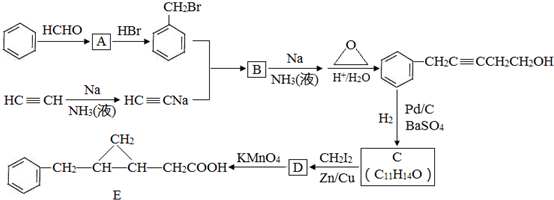
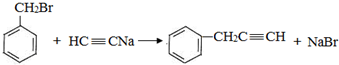 ,反应类型是取代反应.
,反应类型是取代反应.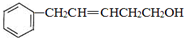 ,C的分子中一定共面的碳原子最多有7个.
,C的分子中一定共面的碳原子最多有7个. 任意2种.
任意2种. .
.