题目内容
3.利用硫酸烧渣(主要成分为Fe2O3和FeO,还含有少量的Al2O3和SiO2等)可产生颜料铁黄(FeOOH),其制备流程如下: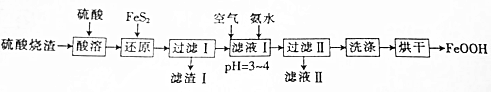
(1)FeS2中Fe元素的化合价为+2.硫元素位于元素周期表第3周期ⅥA族.
(2)酸溶时,没有参与反应的物质是SiO2(填化学式).Al2O3与硫酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O.
(3)滤液Ⅱ中的主要成分硫酸铵可用作氮肥(任写一种用途)
分析 硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有二氧化硅和S、FeS2,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH,以此解答该题.
解答 解:硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)加硫酸溶解,金属氧化物转化为金属阳离子,二氧化硅不溶,再加FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有二氧化硅和S、FeS2,滤液中含有Fe2+和Al3+,滤液中通入空气氧化,同时调节pH生成FeOOH沉淀,过滤、洗涤、烘干,得到纯净的FeOOH.
(1)FeS2中Fe元素的化合价为+2价,硫元素位于元素周期表第3周期ⅥA族,故答案为:+2;3;ⅥA;
(2)二氧化硅与硫酸不反应,Al2O3与硫酸反应生成硫酸铝和水,反应的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:SiO2;Al2O3+6H+=2Al3++3H2O;
(3)硫酸铵含有N元素,可用作氮肥等,故答案为:氮肥.
点评 本题以铁黄(FeOOH)的制备流程为知识背景,考查硅、铁的化合物的性质、离子方程式的书写、物质的分离提纯等,难度中等,清楚工艺流程原理是解题的关键,是对知识迁移的综合运用.

练习册系列答案
相关题目
14.常温下,下列各组离子在给定条件下一定能大量共存的是( )
| A. | pH=0的溶液:Fe2+、Br-、Na+、NO3- | |
| B. | 由水电离产生的c(H+)=1.0×10-12mol•L-1的溶液中:K+、AlO2-、NO3-、Na+ | |
| C. | 中性溶液中:Fe3+、K+、Al3+、SO42- | |
| D. | 在0.1 mol•L-1Na2CO3溶液中:A1O2-、Na+、NO3-、C1- |
15.下列除杂方法正确的是( )
| A. | 除去Fe2O3、Al2O3混合物中的Fe2O3加NaOH溶液 | |
| B. | 除去Na2O2中的Na2O,加热 | |
| C. | 除去Na2CO3固体中的NaHCO3,加NaOH固体 | |
| D. | 除去Fe、C合金中的C,在O2中灼烧 |
18.只用一种试剂可将氯化铵、硫酸铵、氯化钠、硫酸钠四种溶液区别开来的是( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | BaCl2溶液 | D. | Ba(OH)2溶液 |
8.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 等物质量的H2O和CO2所含原子数均为3NA | |
| B. | 1mol由Na2O和Na2O2组成的混合物中,含有的离子数为3.5NA | |
| C. | 1L 12mol•L-1浓盐酸和足量MnO2在加热条件下充分反应,生成的气体的分子数为3NA | |
| D. | 标准状况下,6.72L NO2通入足量的水中,转移的电子数为0.2NA |
17.下列关于元素周期表的结构、性质和用途叙述正确的是( )
| A. | 过渡元素一定是金属元素 | |
| B. | 根据构造原理、泡利原理等核外电子排布规律可预测未来的第八周期包括的元素的种类有64个 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 原子最外层电子数为2的元素一定是 IIA元素 |
18.能使H2O+H2O≒H3O++OH-的电离平衡向电离方向移动,但所得溶液仍呈中性的是( )
| A. | 加入硫酸 | B. | 加入少量氯化铵晶体 | ||
| C. | 继续加水 | D. | 升温 |