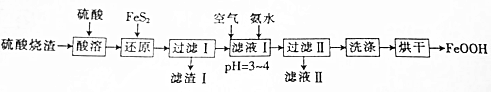
题目内容
8.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 等物质量的H2O和CO2所含原子数均为3NA | |
| B. | 1mol由Na2O和Na2O2组成的混合物中,含有的离子数为3.5NA | |
| C. | 1L 12mol•L-1浓盐酸和足量MnO2在加热条件下充分反应,生成的气体的分子数为3NA | |
| D. | 标准状况下,6.72L NO2通入足量的水中,转移的电子数为0.2NA |
分析 A.没有告诉二者的物质的量,无法计算含义的原子数;
B.过氧化钠中含有的阴离子为过氧根离子,1mol氧化钠和过氧化钠的混合物中含有3mol离子;
C.浓盐酸与二氧化锰的反应中,浓盐酸变成稀盐酸后反应停止,则反应生成的氯气的物质的量减少;
D.标准状况下6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1molNO,转移了0.2mol电子.
解答 解:A.没有告诉H2O和CO2的物质的量,无法计算二者含义的原子数,故A错误;
B.1mol由Na2O和Na2O2组成的混合物中含有2mol钠离子和1mol由氧离子和过氧根离子组成的阴离子,总共含有3mol离子,含有的离子数为3NA,故B错误;
C.1L 12mol•L-1浓盐酸中含有12molHCl,由于稀盐酸不与二氧化锰反应,则12molHCl不会完全反应,所以生成的氯气的物质的量小于3mol,生成的气体的分子数小于3NA,故C错误;
D.标准状况下6.72L二氧化氮的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1molNO,反应中转移了0.2mol电子,转移的电子数为0.2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积之间的关系为解答关键,C为易错点,注意稀盐酸不与二氧化锰反应.

练习册系列答案
相关题目
19.碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )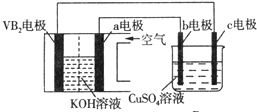

| A. | 电解过程中,c电极表面先有红色物质析出,后有气泡产生 | |
| B. | 外电路中电子由c电极流向VB2电极 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 若B装置内的液体体积为100 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
16.下列叙述不正确的是( )
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |
3.下列关于环境问题的说法不正确的是( )
| A. | pH小于5.6的降雨称为酸雨 | |
| B. | 充分利用太阳能有助于“节能减排” | |
| C. | 在燃煤中加入适量石灰石,有助于环境保护 | |
| D. | 含磷洗涤剂易被细菌分解,不会导致水体污染 |