题目内容
10.蔗糖的化学式是:C12H22O11;淀粉的化学式:(C6H10O5)n;氨基酸的结构简式是:H2N-CHR-COOH羧基的结构简式:-COOH;
羟基的结构简式:-OH;醛基的结构简式:-CHO.
分析 蔗糖的化学式是C12H22O11;淀粉化学式为:(C6H10O5)n;氨基酸的结构简式通式是H2N-CHR-COOH;羧基由羰基和羟基组成;羟基的结构简式-OH;醛基的结构简式为:-CHO.
解答 解:蔗糖的化学式是C12H22O11;淀粉是一种高分子化合物,其化学式为:(C6H10O5)n;氨基酸的结构简式通式是H2N-CHR-COOH;羧基由羰基和羟基组成,结构简式为-COOH;羟基的结构简式-OH;醛基正确的结构简式为:-CHO,故答案为:C12H22O11;(C6H10O5)n;-COOH;-OH;-CHO.
点评 本题考查较为综合,涉及有机物的化学式以及结构简式等知识,为高频考点,较为基础,注意把握有机物的组成以及官能团.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
15.钠与水反应的现象与钠的下列性质无关的是( )
| A. | 钠的熔点较低 | B. | 钠的密度较小 | ||
| C. | 钠的失电子能力较强 | D. | 钠的导电性 |
18.化学知识在生产和生活中有着重要的应用.下列说法中不正确的是( )
①钠的还原性很强,可以置换出硫酸铜溶液中的铜单质
②氧化铝可制作耐火坩埚,只因为氧化铝的化学性质很稳定
③发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2和Na2O均可作呼吸面具中O2的来源
⑤明矾常作为消毒剂
⑥碳酸钠在医疗上是治疗胃酸过多的一种药剂.
①钠的还原性很强,可以置换出硫酸铜溶液中的铜单质
②氧化铝可制作耐火坩埚,只因为氧化铝的化学性质很稳定
③发酵粉中含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2和Na2O均可作呼吸面具中O2的来源
⑤明矾常作为消毒剂
⑥碳酸钠在医疗上是治疗胃酸过多的一种药剂.
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②③④⑥ | D. | ①②④⑤⑥ |
5.在下列各组溶液中,离子间一定能大量共存的是( )
| A. | pH=1的溶液:K+、Cu2+、Br-、SO42- | |
| B. | 含有0.1 mol•L-1I-的溶液:NH4+、Fe3+、SO42-、Cl- | |
| C. | 含有0.1 mol•L-1HCO3-的溶液:Na+、Al3+、NO3-、OH- | |
| D. | 强酸性溶液:K+、Mg2+、NO3-、ClO- |
2.电解是工业生产的常用方法.某研究性小组进行以下相关探究:实验Ⅰ用图1装置电解CuCl2溶液制取少量漂白液:
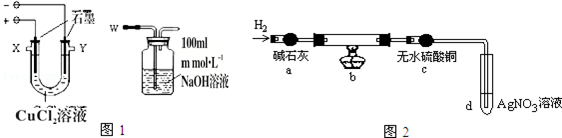
(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.查阅资料显示:
化学小组分析提出:①白色物质为CuCl.
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2=2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{W{\;}_{1}-W{\;}_{2}}{35.5}$mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.

(1)导气管W端应与出气口X连接(填“X”或“Y”).
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.查阅资料显示:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
②红色物质可能有Cu;或者Cu2O;或者二者混合物.
实验Ⅱ为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
(3)无水硫酸铜的作用是检验红色物质中有无Cu2O.
(4)装置b中发生反应的化学方程式是2CuCl+H2=2Cu+2HCl.
(5)电解CuCl2溶液时,阴极上产生白色物质的原因为(用电极反应式解释)Cu2++e-+Cl-=CuCl↓;阴极上产生白色物质的物质的量是$\frac{W{\;}_{1}-W{\;}_{2}}{35.5}$mol.
实验Ⅲ测定漂白液中NaClO的浓度:准确移取20.00mL洗气瓶内混合溶液,加入适量的H2O2溶液,摇匀,滴加2~3滴酚酞试液,用 n mol•L-1盐酸滴定至终点,消耗盐酸V mL.
(6)用化学方程式表示加入H2O2溶液的作用NaClO+H2O2=O2↑+NaCl+H2O.
(7)若忽略洗气瓶内的副反应及体积变化,漂白液中NaClO的浓度为$\frac{20m-nV}{40}$mol•L-1.
19.常温下,一定量的醋酸与氢氧化钠溶液发生中和反应.下列说法正确的是( )
| A. | 当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量 | |
| B. | 当溶液中c(CH3COO-)=c(Na+)时,一定是氢氧化钠过量 | |
| C. | 当溶液中c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全反应 | |
| D. | 当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 |
 (1)实验室常用装置E制备Cl2,写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(1)实验室常用装置E制备Cl2,写出该反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.