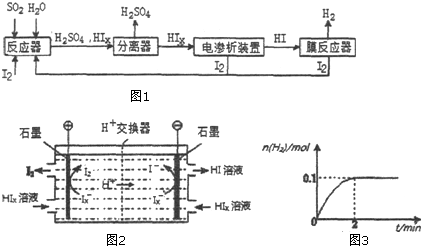
��Ŀ����
18����ѧ֪ʶ��������������������Ҫ��Ӧ�ã�����˵���в���ȷ���ǣ����������ƵĻ�ԭ�Ժ�ǿ�������û�������ͭ��Һ�е�ͭ����
���������������ͻ�������ֻ��Ϊ�������Ļ�ѧ���ʺ��ȶ�
�۷��ͷ��к���̼�����ƣ���ʹ���Ƴ��ĸ�����ɶ��
��Na2O2��Na2O���������������O2����Դ
����������������
��̼������ҽ����������θ������һ��ҩ����
| A�� | �٢ڢۢ� | B�� | �٢ڢܢ� | C�� | �٢ڢۢܢ� | D�� | �٢ڢܢݢ� |
���� ����������Һ��Ӧʵ�ʣ�����ˮ��Ӧ�����������ƣ��������������η������ֽⷴӦ��
���������������ͻ���������Ϊ���������кܸߵ��۵㣻
��̼�����Ʋ��ȶ������ȷֽ�����̼���ƺͶ�����̼��ˮ��
�ܹ���������ˮ��������̼��Ӧ�����������������������������������������ʷ�Ӧ����������������������������
�����������������ԣ���������������������
��̼���Ƽ���̫ǿ��������������θ������ҩ�
��� �⣺���ƵĻ�ԭ�Ժ�ǿ��������ͭ��Һ��Ӧ����������ͭ�����������ơ��������ò���ͭ���ʴ���
���������������ͻ���������Ϊ���������кܸߵ��۵㣬�ʴ���
��̼�����Ʋ��ȶ������ȷֽ�����̼���ƺͶ�����̼��ˮ�����Կ�����Ϊ���ͷۣ�����ȷ��
�ܹ���������ˮ��������̼��Ӧ�����������������������������������������ʷ�Ӧ�����������������������������ʴ���
�����������������ԣ���������������������������ˮ�����ɵ������������о�ˮ���ã�����������������ˮ�����ʴ���
��̼���Ƽ���̫ǿ��������������θ������ҩ�����θ�������̼�����ƣ��ʴ���
��ѡ��D��
���� ������Ҫ�������ʵ����ʡ�����Լ���;�����ʾ�����;����ȷ������ʵ������ǽ���ؼ�����Ŀ�ѶȲ���

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�| A�� | �٢ڢۢ� | B�� | �ڢۢ� | C�� | �ۢ� | D�� | �� |
��ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
��1���÷�Ӧ�Ļ�ѧ����ʽΪCO2��g��+H2��g��?CO��g��+H2O��g����
��2���÷�ӦΪ���ȷ�Ӧ������ȡ����ȡ�����
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬��������BC����ѡ�۷֣���
A��������ѹǿ���� B����������� c��CO������
C��������H2��=������H2O�� D��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��•c��H2��=c��CO��•c��H2O�������жϴ�ʱ���¶�Ϊ830�森
��5��ij�¶��£���CO��ˮ������1mol�������Ϊ1L���ܱ������з�Ӧ���ﵽƽ�����CO2Ϊ0.5mol����ͨ��4molˮ�������ﵽ�µ�ƽ���CO2�����ʵ�������$\frac{5}{6}$mol��
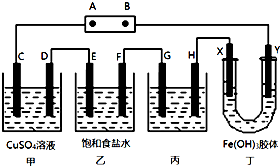 ij�о���ѧϰС�齫����װ����ͼ���ӣ�C��D��E��F��X��Y ���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ���Իش��������⣺
ij�о���ѧϰС�齫����װ����ͼ���ӣ�C��D��E��F��X��Y ���Ƕ��Ե缫������Դ��ͨ�������е����̪��Һ����F�������Ժ�ɫ���Իش��������⣺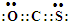 ��
��