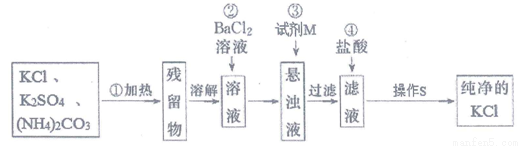
题目内容
17.100mL某溶液含有的离子如表:| 离子 | Cu2- | Al3+ | H+ | Cl- | SO42- |
| c(mol/L) | 1 | 1 | 2 | 3 | a |
| A. | 电路中共转移0.9mol电子 | B. | 铝元素以Al(OH)3的形式存在 | ||
| C. | 阴极质量增加3.2g | D. | a=2 |
分析 用惰性电极电解该溶液,根据离子的放电顺序以及两极收集到的气体在相同条件下的体积相同可知
第一阶段由Cu2+、Cl-放电,阴极生成0.1 mol Cu(析出Cu 6.4 g),阳极生成0.1 mol Cl2,转移电子0.2 mol;
第二阶段由H+、Cl-放电,阴极生成0.05 mol H2,阳极0.05 mol Cl2,转移电子0.1 mol;
第三阶段:由H+、OH-放电,实际上就是电解水,阴极生成x mol H2,阳极生成0.5x mol O2,转移电子2x mol;
两极收集到的气体在相同条件下体积相同,则0.1+0.05+0.5x=x,解得x=0.3,据此分析解答.
解答 解:用惰性电极电解该溶液,根据离子的放电顺序以及两极收集到的气体在相同条件下的体积相同可知
第一阶段由Cu2+、Cl-放电,阴极生成0.1 mol Cu(析出Cu 6.4 g),阳极生成0.1 mol Cl2,转移电子0.2 mol;
第二阶段由H+、Cl-放电,阴极生成0.05 mol H2,阳极0.05 mol Cl2,转移电子0.1 mol;
第三阶段:由H+、OH-放电,实际上就是电解水,阴极生成x mol H2,阳极生成0.5x mol O2,转移电子2x mol;
两极收集到的气体在相同条件下体积相同,则0.1+0.05+0.5x=x,解得x=0.3
A.根据以上三段电解,则共转移电子为0.2+0.1+0.6=0.9 mol,故A正确;
B.由分析可知,上述三个过程分别电解CuCl2、HCl和H2O,溶液中没有生成OH-,铝元素以Al3+形式存在,故B错误;
C.根据以上三段电解,阴极析出0.1 mol Cu,质量增加6.4g,故C错误;
D.根据溶液中电荷守恒可知:2c(Cu2+)+3c(Al3+)+c(H+)=c(Cl-)+2c(SO42-),所以c(SO42-)=2mol•L-1,即a=2,故D正确.
故选:AD.
点评 本题考查了电解原理的应用,电极产物的判断和计算,电极反应遵循电子守恒,依据离子物质的量和电极反应中的电子守恒计算分析判断,综合性较强,侧重于考查学生的分析能力和计算能力.

 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
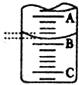
(2)如图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为25.40ml.此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):$\frac{(25.28+25.32)×c×0.1×60}{2V}$
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
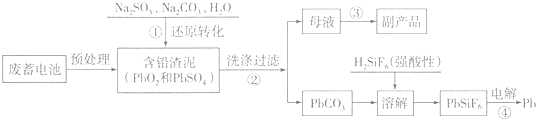
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
回答下列问题:
(1)写出步骤①中PbSO4转化为PbCO3过程的平衡常数表达式K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$,为提高步骤①的反应速率和铅浸出率,你认为可采取的两条措施是充分搅拌、适当升高温度.
(2)步骤①中发生的氧化还原反应的离子方程式为PbO2+SO32-+H2O=PbSO4+2OH-.
(3)写出步骤④用惰性电极电解的阴极反应式Pb2++2e-=Pb.
(4)PbO2在加热过程发生分解的失重曲线如图1所示,已知失重曲线上的a点为样品失重4.0%(即$\frac{样品起始质量-a点固体质量}{样品起始质量}$×100%)的残留固体,若a点固体组成表示为PbOx,计算x=1.4.
(5)铅的加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH变化的关系如图2所示,某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表
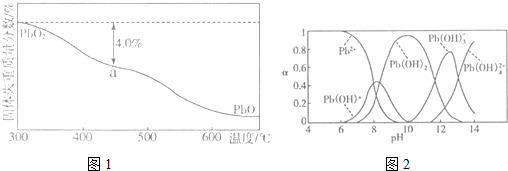
| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
A.4~5 B.6~7 C.9~10 D.11~12.
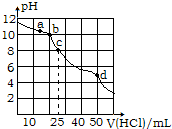
| A. | 该温度下HCO3-的水解常数约为2×10-11 | |
| B. | a点到b点发生的主要离子反应为:HCO3-+H+═H2O+CO2↑ | |
| C. | c点:c(OH-)+c(CO32-)=c(H+)+2c(H2CO3) | |
| D. | d点:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:(1)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形.
(2)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.MgO晶体的熔点高于NaCl晶体主要原因是MgO晶体中所含离子半径小、电荷数多,晶格能大.其中基态C1-的核外电子排布式为:1s22s22p63s23p6.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
(5)CuCl42-是黄色的,而CuCl2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子.
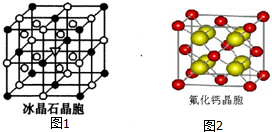
(6)在电解冶炼铝的过程中加入冰晶石(Na3AlF6),可起到降低A12O3熔点的作用.冰晶石由两种微粒构成,冰晶石的晶胞结构如图1甲所示,●位于大立方体的顶点和面心,O位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
(7)已知CaF2晶体(如图2),其中Ca2+的配位数为8.CaF2晶体的密度为ρg•cm-3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
 .
. .
.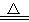 2NH3↑+CO2↑+H2O
2NH3↑+CO2↑+H2O