题目内容
5.根据要求回答下列各题(1)下列说法正确的是④⑦
①纯碱,烧碱,碱式碳酸铜都是碱类物质
②电解质都能导电
③碱性氧化物一定都是金属氧化物,酸性氧化物不一定都是非金属氧化物
④冷的浓硫酸可用铝制容器储存能说明常温下冷的浓硫酸可与铝反应
⑤H2和D2,O2和 O3,H218O和D216O都互为同素异形体,
⑥H,D,T,HD互为同位素
⑦元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
(2)阴离子Xn-含中子N个,X的质量数为A,则m g X元素的气态氢化物中含质子的物质的量是$\frac{m}{A+n}$(A-N+n)mol
(3)按要求写出下列方程式:
①KHSO4熔融状态电离方程式:KHSO4=K++HSO4-
②小苏打与过量石灰乳反应的离子方程式:Ca(OH)2+HCO3-=CaCO3↓+H2O+OH-
(4)①标准状况下,甲烷(CH4)和氧气的混合气体的密度为1.25g•L-1,则该混合气体的摩尔质量为28g/mol,其中甲烷和氧气的体积比为:1:3
②某元素x的最高价含氧酸的化学式为HnXO2n-2,则在元素x的气态氢化物中,x元素的化合价为3n-12
(5)镓(Ga)与铝同族.写出镓的氯化物和氨水反应的化学方程式GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓.
(6)钠长石的化学式为(NaAlSi3O8),用氧化物形式表示为Na2O•Al2O3•6SiO2.
分析 (1)①纯碱为碳酸钠、烧碱为氢氧化钠、碱式碳酸铜是碱式盐;
②电解质不一定导电,是熔融状态或水溶液中电离导电;
③碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物;
④浓硫酸在常温下使铁或铝钝化;
⑤同种元素组成的不同单质为同素异形体;
⑥质子数相同,中子数不同的同种元素的不同原子互称同位素;
⑦依据周期表结构分析,周期表中有七个周期,16个族;
(2)根据质量数=质子数+中子数,计算X的质子数.由阴离子Xn-可知X元素的气态氢化物化学式为HnX,根据n=$\frac{m}{M}$计算氢化物HnX的物质的量,结合化学式计算含有的质子的物质的量;
(3)①熔融硫酸氢钾电离生成钾离子和磷酸氢根离子;
②小苏打和过量石灰乳反应生成碳酸钙、氢氧化钠和水;
(4)①根据M=ρVm计算混合气体的平均摩尔质量,设O2和CH4物质的量分别为xmol、ymol,利用平均摩尔质量列方程计算即可;
②化合物中元素的化合价代数和为零,据此计算X元素的化合价.再利用最高正化合价+|最低负化合价|=8,计算X元素在气态氢化物中的化合价;
(5)类似氯化铝与氢氧化钠溶液反应,根据氯化铝与氢氧化钠的反应书写方程式;
(6)根据硅酸盐化学式可表示为活泼金属氧化物•金属氧化物•非金属氧化物•水进行解答.
解答 解:(1)①纯碱、碱式碳酸铜是盐类物质,烧碱是碱,故①错误;
②电解质不一定都能导电,只有在熔融状态或水溶液中导电,如熔融氯化钠导电、固体氯化钠不导电,故②错误;
③碱性氧化物一定都是金属氧化物,酸性氧化物不一定都是非金属氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,故③错误;
④冷的浓硫酸可用铝制容器储存,是因为常温下铝在浓硫酸中发生钝化,能说明常温下冷的浓硫酸可与铝反应,故④正确;
⑤O2和 O3为同素异形体,H2和D2,是同种物质,H218O和D216O不是单质,故⑤错误,
⑥H,D,T互为同位素,HD是单质不是原子,故⑥错误;
⑦元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行,故⑦正确;
故答案为:④⑦;
(2)阴离子Xn-含中子N个,X的质量数为A,所以X的质子数为A-N,
由阴离子Xn-可知X元素的气态氢化物化学式为HnX,所以1个HnX分子中含有的质子数为A-N+n,
氢化物HnX的摩尔质量为(A+n)g/mol,
mgX元素的气态氢化物中含质子的物质的量$\frac{mg}{(A+n)g/mol}$×(A-N+n)=$\frac{m}{A+n}$(A-N+n)mol,
故答案为:$\frac{m}{A+n}$(A-N+n)mol;
(3)①熔融硫酸氢钾电离生成钾离子和磷酸氢根离子,电离方程式为KHSO4=K++HSO4-,
故答案为:KHSO4=K++HSO4-;
②小苏打和过量石灰乳反应生成碳酸钙、氢氧化钠和水,离子方程式为Ca(OH)2+HCO3-=CaCO3↓+H2O+OH-,
故答案为:Ca(OH)2+HCO3-=CaCO3↓+H2O+OH-;
(4)①混合气体在标准状况下的密度为1.25g/L,则混合气体的平均摩尔质量为:1.25g/L×22.4L/mol=28g/mol,
设CH4和O2物质的量分别为xmol、ymol,
则:$\frac{16x+32y}{x+y}$=28,
整理可得:x:y=1:3,
所以混合气体中CH4和O2的体积比为1:3,
故答案为:28g/mol;1:3;
②令X元素的化合价为a,化合物HnXO2n-2中元素的化合价代数和为零,则:1×n+a+(2n-2)×(-2)=0 解得,a=3n-4
最高正化合价+|最低负化合价|=8,所以氢化物中化合价为最高正化合价-8=3n-4-8=3n-12,
故答案为:3n-12;
(5)同主族元素化学性质相似,因此类比氯化铝与氨水的反应可得氯化稼与氨水反应的方程式,反应的化学方程式为GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓,
故答案为:GaCl3+3NH3+3H2O=3NH4Cl+Ga(OH)3↓;
(6)将(NaAlSi3O8)改写为氧化物形式为Na2O•Al2O3•6SiO2;
故答案为:Na2O•Al2O3•6SiO2.
点评 本题考查了物质性质、元素周期表、原子结构和离子结构、元素化合价计算、物质的量计算应用等知识点,知识点较多,题目难度中等.

 阅读快车系列答案
阅读快车系列答案①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
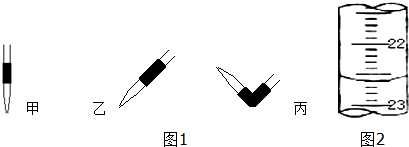
(1)图1排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(2)锥形瓶中的溶液从红色变为无 色时,停止滴定.
(3)有一支50mL 酸式滴定管中盛盐酸,液面恰好在amL 刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是C
A.a mL B.(50-a)mL C.大于(50-a)mL D.大于a mL
(4)该小组在步骤①中的错误待测溶液润洗锥形瓶,由此造成的测定此结果偏高(偏高、偏低或无影响).
(5)图2,是某次滴定时的滴定管中的液面,其读数为22.60mL.
(6)根据下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
已知:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 2.8 |
| A13+ | 3.4 | 4.7 |
| Fe2+ | 5.8 | 8.8 |
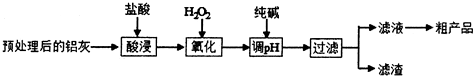
(1)酸浸时温度控制在30℃-35℃,不宜太低,也不宜太高,其原因是温度太低,反应慢;温度太高,盐酸挥发快.
(2)氧化时的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)调节溶液的pH范围为2.8<pH<3.4.
(4)滤渣中主要含有物质的化学式是SiO2、Fe(OH)3.
| A. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| B. | 分子式为C8H10,且属于芳香族化合物的同分异构体只有3种 | |
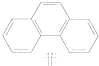
| C. | 菲的结构简式如右图,它与硝酸反应,所得一硝基取代物有5种 | |
| D. | 甲苯苯环上的一个氢原子被一C3H7取代,所得有机产物有6种 |
| 离子 | Cu2- | Al3+ | H+ | Cl- | SO42- |
| c(mol/L) | 1 | 1 | 2 | 3 | a |
| A. | 电路中共转移0.9mol电子 | B. | 铝元素以Al(OH)3的形式存在 | ||
| C. | 阴极质量增加3.2g | D. | a=2 |
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
