题目内容
下表是元素周期表中前三周期的一部分,根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)金属性最强的元素是 ,最不活泼的元素是 .
(2)H的原子结构示意图为 .
(3)最高价氧化物所对应的水化物酸性最强的是 (填化学式).
(4)D与H形成的化合物属于 (填“离子化合物”或“共价化合物”).
(5)最高价氧化物既能与酸反应又能与碱反应的是 (填名称).
(6)E和G对应的氢化物较稳定的是 (填化学式).
(7)I的单质与B的最高价氧化物对应的水化物反应的离子方程式 .
(8)下图是A2与F2发生反应生成A2F的途径和三个状态的总能量(E)
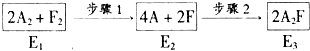
则:①步骤l是 (填“吸热”或“放热”,下同)过程.
②比较E1、E2、E3的大小 .(由大到小顺序排列)
| A | |||||||||||||||||
| D | E | F | |||||||||||||||
| B | C | G | H | I | J |
(2)H的原子结构示意图为
(3)最高价氧化物所对应的水化物酸性最强的是
(4)D与H形成的化合物属于
(5)最高价氧化物既能与酸反应又能与碱反应的是
(6)E和G对应的氢化物较稳定的是
(7)I的单质与B的最高价氧化物对应的水化物反应的离子方程式
(8)下图是A2与F2发生反应生成A2F的途径和三个状态的总能量(E)
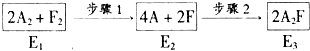
则:①步骤l是
②比较E1、E2、E3的大小
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为P,H为S,I为Cl,J为Ar,
(1)碱金属的金属性最强,稀有气体的性质最不活泼;
(2)S的质子数为16,有3个电子层,最外层电子数为6;
(3)Cl的最高价氧化物对应的水化物酸性最强;
(4)D与H形成的化合物为CS2;
(5)Al的最高价氧化物为两性氧化物;
(6)非金属性越强,对应的氢化物越稳定;
(7)氯气与NaOH反应生成NaCl、NaClO;
(8)①化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量;
②放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合氢气燃烧为放热反应判断.
(1)碱金属的金属性最强,稀有气体的性质最不活泼;
(2)S的质子数为16,有3个电子层,最外层电子数为6;
(3)Cl的最高价氧化物对应的水化物酸性最强;
(4)D与H形成的化合物为CS2;
(5)Al的最高价氧化物为两性氧化物;
(6)非金属性越强,对应的氢化物越稳定;
(7)氯气与NaOH反应生成NaCl、NaClO;
(8)①化学键断裂形成原子需要吸收能量,原子之间形成化学键放出能量;
②放热过程生成物的总能量小于反应物总能量,吸热过程生成物的总能量高于反应物总能量,结合氢气燃烧为放热反应判断.
解答:
解:由元素在周期表的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为P,H为S,I为Cl,J为Ar,
(1)上述元素中,Na的金属性最强,Ar的性质最不活泼,故答案为:Na;Ar;
(2)S的质子数为16,有3个电子层,最外层电子数为6,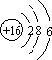 故答案为:
故答案为: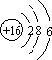 ;
;
(3)Cl的最高价氧化物对应的水化物HClO4的酸性最强,故答案为:HClO4;
(4)D与H形成的化合物为CS2,只含共价键,为共价化合物,故答案为:共价化合物;
(5)Al的最高价氧化物为氧化铝,为两性氧化物,既能与酸反应又能与碱反应,故答案为:氧化铝;
(6)非金属性N>P,则对应的氢化物NH3稳定,故答案为:NH3;
(7)氯气与NaOH反应生成NaCl、NaClO,该离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(8)①步骤l中化学键断裂形成原子,应是吸热过程,步骤2是原子之间形成化学键生成新物质,放出热量,
故答案为:吸热;
②步骤1为吸热过程,故E2>E1,步骤2是放热过程,故E2>E3,由于氢气燃烧为放热反应,故E1>E3,故E2>E1>E3,
故答案为:E2>E1>E3.
(1)上述元素中,Na的金属性最强,Ar的性质最不活泼,故答案为:Na;Ar;
(2)S的质子数为16,有3个电子层,最外层电子数为6,
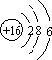 故答案为:
故答案为: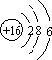 ;
;(3)Cl的最高价氧化物对应的水化物HClO4的酸性最强,故答案为:HClO4;
(4)D与H形成的化合物为CS2,只含共价键,为共价化合物,故答案为:共价化合物;
(5)Al的最高价氧化物为氧化铝,为两性氧化物,既能与酸反应又能与碱反应,故答案为:氧化铝;
(6)非金属性N>P,则对应的氢化物NH3稳定,故答案为:NH3;
(7)氯气与NaOH反应生成NaCl、NaClO,该离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(8)①步骤l中化学键断裂形成原子,应是吸热过程,步骤2是原子之间形成化学键生成新物质,放出热量,
故答案为:吸热;
②步骤1为吸热过程,故E2>E1,步骤2是放热过程,故E2>E3,由于氢气燃烧为放热反应,故E1>E3,故E2>E1>E3,
故答案为:E2>E1>E3.
点评:本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素化合物性质为解答的关键,题目较为综合,注意基础知识的理解掌握,题目难度不大.

练习册系列答案
相关题目
NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B、0.1mol 24Mg32S晶体中所含中子总数为2.8NA |
| C、常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L |
| D、在熔融状态下,1mol NaHSO4完全电离出的阳离子数目为2NA |
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表.下列说法正确的是( )
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.