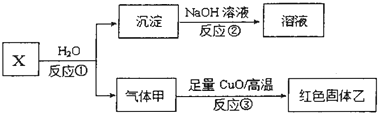
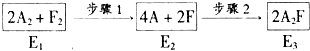题目内容
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是( )
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:铊在周期表中位于第六周期,与铝是同族元素,同主族元素从上到下,元素的金属性逐渐增大,利用同主族元素的性质变化规律来解答.
解答:
解:A.铝为银白色金属,Tl与Al同主族,则铊是银白色金属,故A正确;
B.同主族从上到下金属性增强,则Tl(OH)3是碱性氢氧化物,故B错误;
C.第ⅢA族的最高价为+3,且为金属元素,则能生成+3价离子化合物,故C正确;
D.金属性Tl>Al,则Tl3+的氧化能力比Al3+弱,故D错误.
故选BD.
B.同主族从上到下金属性增强,则Tl(OH)3是碱性氢氧化物,故B错误;
C.第ⅢA族的最高价为+3,且为金属元素,则能生成+3价离子化合物,故C正确;
D.金属性Tl>Al,则Tl3+的氧化能力比Al3+弱,故D错误.
故选BD.
点评:本题考查元素的性质,为高频考点,侧重于学生的分析能力的考查熟悉元素在周期表中的位置及元素周期律是解答本题的关键,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
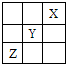 短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,下列叙述中正确的是( )| A、Z的最高化合价为+6价 |
| B、X的最高价氧化物的水化物是一种强酸 |
| C、1molY的单质跟足量水反应时,发生转移的电子为1mol |
| D、Z一定是活泼金属元素 |
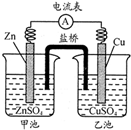 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:

下列有关三聚氰酸的说法正确的是( )

下列有关三聚氰酸的说法正确的是( )
| A、分子式为C3H6N303 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |
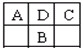 A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )
A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )| A、A的氧化物有多种形式 |
| B、B的最高价氧化物对应的水化物是一种强酸 |
| C、D元素形成的单质不止一种 |
| D、C的氢化物水溶液通常用玻璃试剂瓶盛放 |