题目内容
NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B、0.1mol 24Mg32S晶体中所含中子总数为2.8NA |
| C、常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L |
| D、在熔融状态下,1mol NaHSO4完全电离出的阳离子数目为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.电解硝酸钙溶液时,阴极放电的是氢离子,不是钙离子;
B.24Mg32S中含有28个中子,0.1mol24Mg32S中含有2.8mol中子;
C.降低温度平衡向放热方向进行,二氧化氮反应生成四氧化二氮的反应是放热反应;
D.熔融硫酸氢钠完全电离出钠离子和硫酸氢根离子.
B.24Mg32S中含有28个中子,0.1mol24Mg32S中含有2.8mol中子;
C.降低温度平衡向放热方向进行,二氧化氮反应生成四氧化二氮的反应是放热反应;
D.熔融硫酸氢钠完全电离出钠离子和硫酸氢根离子.
解答:
解:A.用惰性电极电解硝酸钙溶液时,氢离子氧化性大于钙离子,所以阴极放电的不是钙离子,电解过程中不会生成金属钙,故A错误;
B.0.1mol 24Mg32S晶体中所含中子的物质的量为2.8mol,含有中子总数为2.8NA,故B正确;
C.降低温度平衡向放热方向进行,二氧化氮反应生成四氧化二氮,分子数减少,气体的物质的量小于1mol,标况下混合气体的体积小于22.4L,故C错误;
D.熔融状态下,1mol硫酸氢钠能够电离出的阳离子只有1mol钠离子,阳离子数目为NA,故D错误;
故选B.
B.0.1mol 24Mg32S晶体中所含中子的物质的量为2.8mol,含有中子总数为2.8NA,故B正确;
C.降低温度平衡向放热方向进行,二氧化氮反应生成四氧化二氮,分子数减少,气体的物质的量小于1mol,标况下混合气体的体积小于22.4L,故C错误;
D.熔融状态下,1mol硫酸氢钠能够电离出的阳离子只有1mol钠离子,阳离子数目为NA,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确熔融硫酸氢钠电离出的阳离子为钠离子、二氧化氮与四氧化二氮之间存在转化平衡,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
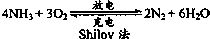 以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应如图:有关下列说法错误的是( )
以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应如图:有关下列说法错误的是( )| A、氨燃料电池在充电时,OH-向电池的负极移动 |
| B、氨燃料电池在放电时,负极反应为:2NH3-6e-+6OH-═N2+6H2O |
| C、以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D、燃料电池的能量转化率一般比普通的电池高 |
下列对应关系正确的是( )
| A | B | C | D |
 |
 |
 |
 |
| 浓硫酸 | 氢氧化钠 | 废旧灯管 | 废旧易拉罐 |
| A、A | B、B | C、C | D、D |
下列实验装置或操作正确的是( )
A、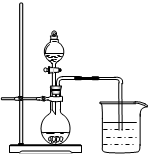 向Ⅰ中通入过量CO2,出现白色沉淀,则溶液中一定含有AlO2- |
B、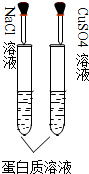 两支试管中蛋白质溶液均会变性 |
C、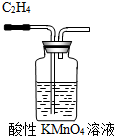 除去C2H4中的SO2 |
D、 海带灼烧成灰 |
下列各组离子在水溶液中能大量共存的是( )
| A、Na+、HCO3-、SO32-、OH- |
| B、Al3+、H+、SiO32-、I- |
| C、Fe2+、K+、NO3-、SO42- |
| D、Fe3+、NH4+、ClO-、CO32- |