题目内容
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表.下列说法正确的是( )
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W是原子序数依次增大的短周期元素,X原子的K层电子数是L层电子数的2倍,其L层电子数为1,则X为Li元素;Y的一种核素在考古时常用来鉴定一些文物的年代,则Y为C元素;Z所处的周期序数与族序数相等,原子序数大于碳,只能处于第三周期,故Z为Al;W的最高价氧化物对应的水化物酸性最强,则W为Cl,结合元素周期律与元素化合物性质解答.
解答:
解:X、Y、Z、W是原子序数依次增大的短周期元素,X原子的K层电子数是L层电子数的2倍,其L层电子数为1,则X为Li元素;Y的一种核素在考古时常用来鉴定一些文物的年代,则Y为C元素;Z所处的周期序数与族序数相等,原子序数大于碳,只能处于第三周期,故Z为Al;W的最高价氧化物对应的水化物酸性最强,则W为Cl,
A.电子层越多离子半径越大,故离子半径Cl->Al3+,故A正确;
B.非金属性Cl>C,故氢化物中HCl更稳定,故B错误;
C.氢氧化铝溶于强酸、强碱,不能溶于弱酸碳酸,故C正确;
D.Li在氧气中燃烧生成Li2O,故D错误,
故选AC.
A.电子层越多离子半径越大,故离子半径Cl->Al3+,故A正确;
B.非金属性Cl>C,故氢化物中HCl更稳定,故B错误;
C.氢氧化铝溶于强酸、强碱,不能溶于弱酸碳酸,故C正确;
D.Li在氧气中燃烧生成Li2O,故D错误,
故选AC.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,侧重对基础知识的巩固,注意D选项中碱金属元素性质的递变性.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
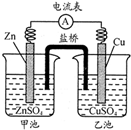 中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )
中学教材引入了带盐桥的原电池,该电池即为1806年丹尼尔设计的原电池.如图,下列有关分析正确的是( )| A、负极发生氧化反应:Cu-2e-=Cu2+ |
| B、电池工作时,盐桥逐渐变蓝 |
| C、向乙池中通入H2S后,电池反应停止 |
| D、若将电极Cu改为石墨,电池电流强度发生变化 |
CO2的资源化利用是解决温室效应的重要途径,如图是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:

下列有关三聚氰酸的说法正确的是( )

下列有关三聚氰酸的说法正确的是( )
| A、分子式为C3H6N303 |
| B、分子中既含极性键,又含非极性键 |
| C、属于共价化合物 |
| D、生成该物质的上述反应为中和反应 |
能正确表示下列反应的离子方程式是( )
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
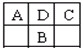 A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )
A、B、C、D为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )| A、A的氧化物有多种形式 |
| B、B的最高价氧化物对应的水化物是一种强酸 |
| C、D元素形成的单质不止一种 |
| D、C的氢化物水溶液通常用玻璃试剂瓶盛放 |
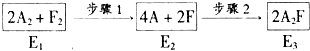
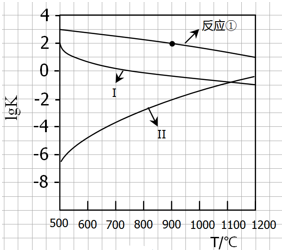 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.