题目内容
18.向含有0.2mol Fel2的溶液中加入a mol Br2.下列叙述不正确的是( )| A. | 当a=0.1时,发生的反应为2I-+Br2═I2+2Br- | |
| B. | 当a=0.25时,发生的反应为2Fe2++4I-+3Br2═2Fe3++2I2+6Br- | |
| C. | 当溶液中I-有一半被氧化是,c(I-):c(Br-)═1:1 | |
| D. | 当a=0.28时,4Fe2++10I-+7Br2═4Fe3++5I2+14Br- |
分析 亚铁离子的还原性小于碘离子,溴少量时碘离子优先被氧化,发生反应为:2I-+Br2═I2+2Br-;当碘离子完全被氧化后,亚铁离子开始被溴单质氧化,溴足量时的反应方程式为:2Fe2++4I-+3Br2═2Fe3++2I2+6Br-,据此进行解答.
解答 解:A.a=0.1时,溴单质不足,只有碘离子被氧化,反应的离子方程式为:2I-+Br2═I2+2Br-,故A正确;
B.当a=0.25时,0.2molFeI2的溶液中含有0.2mol亚铁离子、0.4mol碘离子,0.4mol碘离子完全反应消耗0.2mol溴单质,剩余的0.05mol溴单质能够氧化0.1mol亚铁离子,所以正确的反应为:2Fe2++8I-+5Br2═2Fe3++4I2+10Br-,故B错误;
C.当溶液中I-有一半被氧化时,即当有0.2mol碘离子被氧化时,消耗0.1mol溴单质生成0.2mol溴离子,则反应后溶液中碘离子和溴离子浓度相等,故C正确;
D.当a=0.28时,0.2molFeI2的溶液中含有0.2mol亚铁离子、0.4mol碘离子,0.4mol碘离子完全反应消耗0.2mol溴单质,剩余的0.08mol溴单质能够氧化0.16mol亚铁离子,所以正确的反应为:4Fe2++10I-+7Br2═4Fe3++5I2+14Br-,故D正确;
故选B.
点评 本题考查了氧化还原反应的计算,题目难度中等,明确亚铁离子与碘离子的还原性强弱及发生反应的先后顺序为解答关键,试题充分培养了学生的分析能力及灵活应用能力.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
18.将某文献资料上记载的相对原子质量数据摘录如表:
试回答下列问题:(1)34.969表示同位素35Cl相对原子质量 (2)35.485是表示氯元素的近似相对原子质量.
| 35Cl | 34.969 | 75.77% | 35Cl | 35 | 75.77% |
| 37Cl | 36.969 | 24.23% | 37Cl | 37 | 24.23% |
| 平均 | 35.453 | 平均 | 35.485 | ||
13.某烯烃与H2加成后的产物为 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )
 ,则该烯烃的结构简式可能有( )
,则该烯烃的结构简式可能有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
8.仪器名称为“量筒”的是( )
| A. |  | B. |  | C. |  | D. |  |
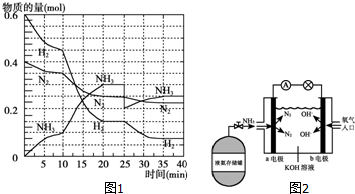 氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示:
氨在工农业生产中应用广泛.德国人哈伯发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图1所示: 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用图1装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.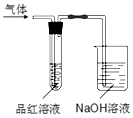 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题: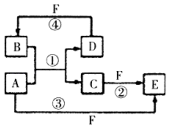 (1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题:
(1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题: ;
; ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.